|
Zusammenfassung
- Enzyme sind Stoffe, die chemische Reaktionen in biologischen Systemen
extrem beschleunigen können, ohne dabei selbst verbraucht zu werden. Sie werden auch
Biokatalysatoren genannt. Ohne Enzyme könnte unser Stoffwechsel nicht ablaufen.
- Die Vermehrung (seltener die Verminderung) bestimmter Enzyme im Blut
kann ein Hinweis auf bestimmte Krankheiten sein. Bestimmungen der Enzymaktivität im Blut
sind daher häufig Teil einer Laboruntersuchung. Selten bestimmt man Enzyme in anderen
Proben (Harn, Stuhl).
- Enzyme werden in der Labormedizin auch als Hilfsmittel bei der
Bestimmung anderer Laborwerte (z.B. Blutzucker oder Harnsäure) eingesetzt. Auch
Antigen-Antikörper Reaktionen kann man durch Kopplung mit einer enzymatischen
Farbreaktion sichtbar machen.
- Der Ablauf enzymatischer Reaktionen lässt sich durch Enzymkinetiken
beschreiben, deren wichtigste Faktoren die Substratkonzentration (S), die
Reaktionsgeschwindigkeit (v), die Michaelis-Konstante (Km) und die Maximalgeschwindigkeit
(Vmax) sind.
|
|
|
|
|
|
|
|
|
|
|
|
I.
Einleitung
Woher kommt der Name "Enzym"
Enzym: Im Griechischen heißt "zymoma"
Hefe (oder Sauerteig), die Silbe "en-" steht im Griechischen für
"in". Hefezellen enthalten Enzyme (früher auch Fermente genannt).
Um 1900 isolierte der Münchner Chemiker Enzyme aus Hefezellen. Er bekam später
für seine "Arbeiten zur zellfreien Gärung" den Nobelpreis.
Was sind Enzyme?
Enzyme sind Stoffe, die chemische Reaktionen in biologischen
Systemen extrem beschleunigen können, ohne dabei selbst verändert oder verbraucht zu
werden. Sie werden auch Biokatalysatoren genannt.
Die Enzymwirkung kann eine Reaktion Tausend-Milliarden-fach (1012) und
noch viel mehr beschleunigen (Bereich etwa 108 bis 1020-fach). Viele
Stoffwechselvorgänge in unserem Körper würden ohne Enzyme praktisch nicht ablaufen
können. Reaktionen, die nur Millisekunden brauchen, würden ohne Enzyme Jahre benötigen.
Auch wenn es streng genommen nicht stimmt, kann man daher sagen: erst durch Enzymwirkung
werden diese Stoffwechselvorgänge möglich.
Fast alle Enzyme unseres Körpers gehören zur Gruppe der Proteine (Eiweißstoffe).
Wie funktionieren Enzyme?
Enzyme haben ein sog. aktives Zentrum. An dieses wird der
umzuwandelnde Stoff, nennen wir ihn "S", gebunden. Danach kommt es zu
Wechselwirkungen zwischen Stoff S und dem Enzym. Dabei wird Stoff S ein wenig
verändert und dadurch reaktionsbereit. Noch während der Stoff S mit dem Enzym
verbunden ist, erfolgt die eigentliche Reaktion, die Umwandlung in einen anderen Stoff,
nennen wir ihn "P". Stoff P trennt sich dann vom Enzym. Das Enzym ist somit
frei, und kann wieder einen Stoff S anlagern.
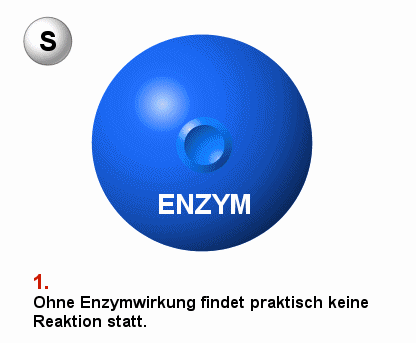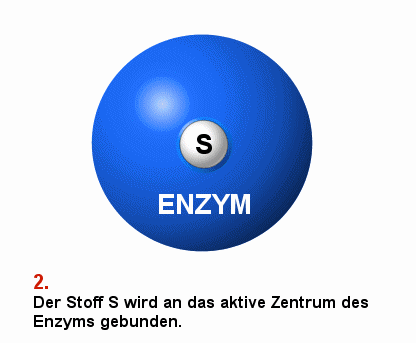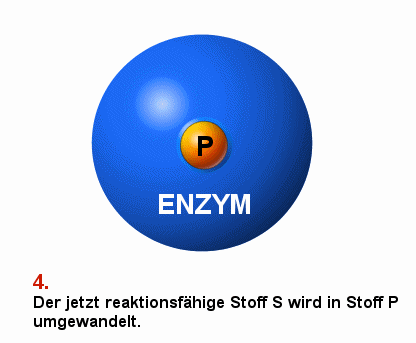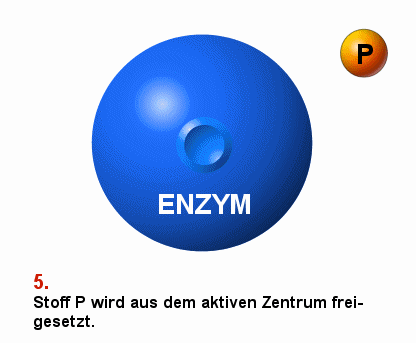 |
Schema einer enzymatisch vermittelten Reaktion S bezeichnet den Ausgangsstoff, das Substrat
P bezeichnet das Produkt der Reaktion
Die Darstellung ist vereinfachend. Meist sind mehrere Stoffe
an der Substrat-Produkt-Reaktion beteiligt. |
| Aus Gründen der Anschaulichkeit läuft diese Animation sehr
langsam ab. In der Realität ist das Gegenteil der Fall. Ein einziges Enzym-Molekül ist
pro Minute an der Umwandlung von Tausenden bis Millionen von Substratmolekülen beteiligt
(diese Zahl, auch Wechselzahl genannt, ist von Enzym zu Enzym
verschieden). |
Definitionen
- Der Stoff, dessen Reaktion/Umsetzung das Enzym beschleunigt, nennt
man das Substrat.
- Der Stoff, der bei einer Enzym-vermittelten Umwandlung entsteht,
nennt man das Produkt.
Enzyme sind wählerisch (spezifisch)
- Substratspezifität: Ein Enzym reagiert meist nur
mit einem ganz bestimmten Substrat (Stoff). Andere, selbst sehr ähnliche Stoffe, passen
nicht in das aktive Zentrum des Enzyms.
Manche Enzyme reagieren zwar mit verschiedenen Stoffen, aber dann meist mit einer
ganz bestimmten chemischen Gruppe oder Verbindungsart, die in diesen verschiedenen Stoffen
in gleicher Weise vorkommt.
- Reaktionsspezifität: Ein Enzym löst meist nur eine
ganz bestimmte Reaktion aus.
Enzymnamen tragen meist die Endung
"-ase"
- Die Endung des Enzymnamens ist im Allgemeinen "-ase".
- Der erste Teil des Namens sagt oft etwas über das Substrat des
Enzyms aus (z.B.Lipase: das Fett-(Lipid-)spaltende Enzym der Bauchspeicheldrüse).
- Aber auch das Produkt kann im Namen aufscheinen (z.B.
Glutamat-Pyruvat-Transaminase = GPT, die in der Leber vorkommt und heute ALT genannt
wird).
Die internationale Vereinigung für Biochemie hat zwar genaue Regeln
für die Nomenklatur der Enzyme aufgestellt, in der Medizin werden aber vielfach davon
abweichende Namen verwendet.
Welche Bedeutung haben Enzyme in der
Labormedizin?
|
|
|
|
 |
|
|
|
|
II.
Messung von Enzymen im Blut (bzw. Serum)
A. Grundlagen
Die Einführung von Enzymbestimmungen in den 60er- und 70er-Jahren
des vorigen Jahrhunderts war eine ganz wesentliche Entwicklung in der Labormedizin.
Manche der im Laufe der Jahre eingeführten Enzymtests haben sich zwar nicht
durchgesetzt und wurden wieder verlassen, die heute noch durchgeführten Tests sind aber
ein wichtiger und selbstverständlicher Teil einer medizinischen Laboruntersuchung.
Aus geschädigten Zellen gelangen
Enzyme ins Blut
Wenn Zellen geschädigt werden, dann werden ihre Zellmembranen (Hüllen) löchrig und
durchlässig. Verschiedene Stoffe treten dann aus den Zellen aus und gelangen ins Blut.
Darunter sind auch Enzyme.
Die Enzymbestimmung zeigt, welches Organ geschädigt ist
Da bestimmte Enzyme in bestimmten Organen vorkommen, zeigt das Auftreten bzw. die
Vermehrung eines bestimmten Enzyms im Blut die Schädigung eines bestimmten Organs an.
Auch Verminderungen von Enzymen im
Blut können Ausdruck einer Erkrankung sein
Zu nennen wäre hier vor allem die Verminderung der in der Leber hergestellten
Cholinesterase bei Lebererkrankungen. Sehr selten ist die durch eine Erbkrankheit bedingte
Verminderung der Alkalischen Phosphatase.
Wie bestimmt man ein Enzym im Blut ?
Die obigen Absätze haben die Wichtigkeit der Enzymbestimmungen im Blut dargelegt, aber
wie kann man Enzyme im Blut, genauer gesagt in der Blutflüssigkeit (im Serum) nachweisen?
Da gibt es zwei prinzipiell unterschiedliche Methoden
- Direkte Bestimmung der Enzymkonzentration
(schwierig, daher selten durchgeführt)
Man kann ein Enzym im Serum mit Spezialmethoden direkt nachweisen und seine Konzentration
bestimmen. Das funktioniert z.B., indem man spezielle Antikörper gegen das Enzym
herstellt. Eine solche Bestimmungsmethode wird zur Bestimmung eines Herz-Enzyms (der
CK-MB) fallweise eingesetzt. Im Allgemeinen ist der direkte Enzymnachweis aber zu
aufwändig, auch weil Enzyme im Serum nur in sehr geringer Konzentration vorhanden sind.
Es gibt elegantere Wege, Enzyme zu bestimmen.
 |
Die Darstellung links symbolisiert ein Enzymmolekül in der Blutflüssigkeit (Serum). Die
Enzyme liegen im Serum nur in sehr geringer Konzentration vor. Eine direkte Bestimmung,
also eine Bestimmung des Enzyms selbst, ist möglich aber oft schwierig. |
- Bestimmung der Aktivität des Enzyms im Serum
(für die meisten Enzyme ist dies die Methode der Wahl )
Wie oben erwähnt, ist ein einziges Enzym-Molekül in der Lage, in einer Minute
Zig-Tausende Substrat-Moleküle umzuwandeln. Das macht man sich zunutze um Enzyme
nachzuweisen:
Man bietet dem Enzym ein geeignetes Substrat an, lässt das Enzym eine Zeit lang arbeiten
und misst dann die Zig-Tausend entstandenen Produkt-Moleküle. Das ist meist leichter als
das eine Enzym-Molekül selbst nachzuweisen.
Statt zu messen, wieviel Produkt entstanden sind, kann man natürlich auch messen, wieviel
Substrat verschwunden ist.
Man muss sich zwar bewusst sein, dass man so nicht die Menge des Enzyms sondern
seine Aktivität im Blut bestimmt, das ist aber kein großes Problem. Unter geeigneten
Bedingungen ist die Aktivität zur Enzymmenge proportional.
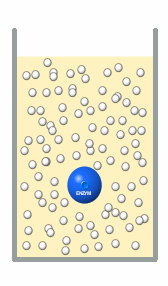 |
Bestimmung der Enzymaktivität im Serum
1. Schritt: Man setzt dem Serum Substrat zu (graue Kugeln). Unter
geeigneten Bedingungen (optimaler pH-Wert, richtige Temperatur) wird das Enzym damit
beginnen, das Substrat umzusetzen. Und zwar sehr große Mengen, viel mehr als in den
Abbildung dargestellt werden kann. |
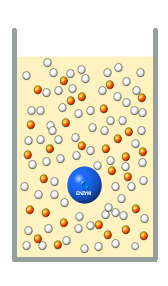 |
2. Schritt: Nach einer bestimmten Zeit
misst man, wie viele Substratmoleküle umgesetzt sind, also wie viele orangene Kugeln
entstanden sind (für die meisten Enzymmessungen genügt dazu ein einfaches Photometer). Alternativ kann man auch die Abnahme des
Substrates (der grauen Kugeln) messen.
Das Ergebnis ist die Anzahl der umgewandelten Moleküle pro Zeiteinheit, also anders
ausgedrückt, die Reaktionsgeschwindigkeit. |
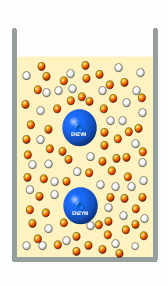 |
Je mehr Enzym im Serum, desto mehr Substrat wird
umgesetzt.
Waren zwei Enzyme im Serum, ist die Reaktionsgeschwindigkeit doppelt so hoch und es werden
doppelt so viele orangene Kugeln produziert. Die Reaktionsgeschwindigkeit ist also
proportional zur Enzymkonzentration.
|
Wovon hängt die Reaktionsgeschwindigkeit
wirklich ab?
Es scheint, als hätten wir eine einfache Möglichkeit gefunden, auf
die Enzymmenge im Serum rückzuschließen.
Aber ist es tatsächlich so? Hängt die Reaktionsgeschwindigkeit wirklich nur von der
Enzymmenge ab? Oder auch von der zugesetzten Substratmenge?
Mit dieser Problematik befassten sich vor ca. 100 Jahren der
Deutsch-Amerikaner Michaelis und die Kanadierin Menten und sie beschrieben folgende
Beziehung zwischen Substratkonzentration und Reaktionsgeschwindigkeit (bei konstanter
Enzymkonzentration):
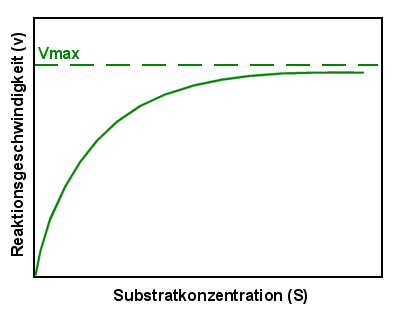 |
Michaelis-Menten-Kurve
Zeigt die Abhängigkeit der Reaktionsgeschwindigkeit von der Substratkonzentration.
Ist kein Substrat vorhanden (ganz links) findet auch keine Reaktion statt. Steigt
die Substratkonzentration an, steigt auch die Reaktionsgeschwindigkeit. Steigt die
Substratkonzentration weiter, nähert sich die Reaktionsgeschwindigkeit einer
Maximalgeschwindigkeit (Vmax). |
Dieses Diagramm zeigt uns, dass die Reaktionsgeschwindigkeit
mit zunehmender Substratkonzentration steigt. Aber nur anfangs. Wird die
Substratkonzentration sehr hoch, nähert sich die Reaktionsgeschwindigkeit einem Maximum,
das nicht mehr überschritten wird.
Man kann sich das auch recht gut vorstellen: bei niedrigen Substratkonzentration (im
Diagramm links) ist wenig Substrat aber relativ viel Enzym vorhanden. Bietet man dem Enzym
mehr Substrat, dann wird es auch mehr umsetzen. Steigt die Substratkonzentration aber
weiter (im Diagramm rechts) ist das vorhandene Enzym irgendwann gesättigt. Mehr Substrat
kann es dann nicht mehr umsetzen, auch wenn man noch mehr dazugibt
Wovon hängt die Reaktionsgeschwindigkeit
ab, wenn man Substrat im Überschuss dazugibt?
Gibt man Substrat im Überschuss dazu, dann erreicht man die
Maximalgeschwindigkeit Vmax. Und wovon hängt die Höhe von Vmax ab? Von der Enzymmenge.
Mehr Enzym kann auch mehr umsetzen.
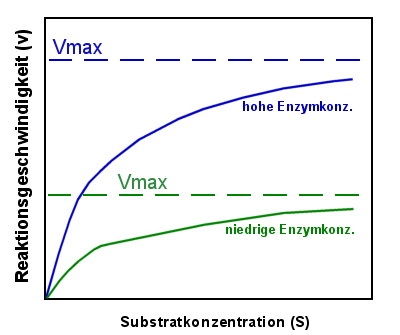 |
Michaelis-Menten-Kurven bei zwei verschiedenen
Enzymkonzentrationen
Die grüne Kurve beschreibt ein System mit niedriger, die blaue Kurve eines mit hoher
Enzymkonzentration. Je höher die Enzymkonzentration, desto höher ist die erreichbare
Maximalgeschwindigkeit Vmax. |
Was bedeutet das für die Enzymbestimmungen
im Serum?
Da man bei der Untersuchung auf die Enzymmenge rückschließen will,
muss in den Testansätzen zur Bestimmung von Enzymen im Serum immer ein Überschuss
von Substrat vorhanden sein. Dann hängt die Reaktionsgeschwindigkeit und damit
die gemessene Enzymaktivität tatsächlich nur mehr von der Enzymmenge ab.
Daneben müssen natürlich die übrigen Reaktionsbedingungen (vor allem Temperatur,
pH-Wert), konstant gehalten werden.
Werden Enzyme auch in anderen
Probenmaterialien untersucht?
Ja, aber selten. So kann die Verminderung des Chymotrypsins oder der
Elastase im Stuhl Hinweis auf ein Problem der Bauchspeicheldrüse sein. Teilweise misst
man auch noch die Amylase im Harn, deren Erhöhung Zeichen einer Schädigung von
Verdauungsdrüsen (Bauchspeicheldrüse, Ohrspeicheldrüse) sein kann. Andere Enzyme
gelangen kaum in den Harn (sind zu groß). |
|
|
|
 |
|
B.
Enzymmessung in der Praxis
Vieles wurde in den obigen Darstellungen zum besseren Verständnis
stark vereinfacht dargestellt. Ein paar Dinge seien daher nachträglich ergänzt:
Man muss oft mehrere Substanzen zuführen
Oft reicht es nicht, nur ein Substrat zuzuführen, man muss 2 oder
mehrere Stoffe hinzugeben. Auch spezielle Inhibitoren (Hemmstoffe) oder Aktivatoren
können nötig sein.
Die Detektion des Substratumsatzes ist nicht
immer so einfach
Wie oben dargestellt, ist es zur Ermittlung der Enzymaktivität
entscheidend zu wissen, wie viel Substrat pro Zeiteinheit umgesetzt wurde. Und es wurde
gesagt, man misst einfach das entstehende Produkt im Photometer. Das ist die einfachste
Möglichkeit. Und für manche Enzyme gibt es tatsächlich solche Nachweisreaktionen, z.B.
für die Gamma-Glutamyl-Transferase (GGT).
Bietet man diesem Enzym zwei bestimmte Substrate dann entsteht als Produkt ein Farbstoff,
den man im Photometer messen kann.
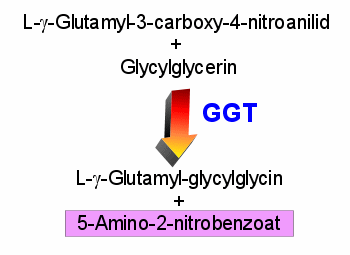 |
Messung der Aktivität der Gamma-GT
Lassen Sie sich durch das Chemie-Chinesisch nicht abschrecken. Es ist ganz einfach. Oben
sind die 2 Substrate, die im Testansatz im Überschuss enthalten sind. Unter Wirkung der
Gamma-GT (aus dem beigemischten Serum) entstehen die 2 untenstehenden Produkte. Eines
davon (violett unterlegt) kann man im Photometer bei 405 nm messen. |
Für viele anderen Enzyme ist es aber nicht so einfach. Wenn
man die Zunahme des entstehenden Produkts nicht im Photometer messen kann und auch die
Messung der Abnahme des Substrats (als zweitbeste Möglichkeit) nicht möglich ist, muss
man andere Wege suchen.
Meist wird man mit den bei der Enzymreaktion entstehenden Produkten
eine weitere chemische Reaktion einleiten. Man wird eine Reaktion wählen, bei der ein
photometrisch zu messendes Substrat oder Produkt vorkommt. Diese zweite Reaktion wird auch
Indikatorreaktion genannt.
Man muss dem Testansatz natürlich alle notwendigen Reagenzien in ausreichender Menge
hinzufügen, damit die Indikatorreaktion unbehindert ablaufen kann. Dann sind die
Veränderungen der Reagenzien der Indikatorreaktion ein Maß für die zu bestimmende
Enzymaktivität.
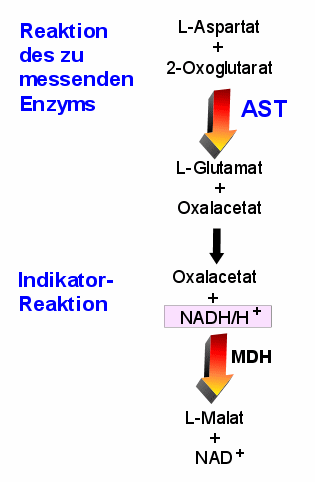 |
Messung der Aktivität der AST (=GOT)
Bei der eigentlichen Reaktion des Enzyms (oben) bietet sich keine Möglichkeit einer
photometrischen Beobachtung.
Also gibt man noch Reagenzien für eine weitere Reaktion in den Testansatz,
darunter auch ein Enzym, die Malatdehydrogenase (MDH). Diese wandelt das in der ersten
Reaktion entstandene Oxalacetat in Malat um. Dabei wird NADH/H+ verbraucht.
Die Abnahme des NADH/H+ kann man photometrisch bei 340 nm messen.Geschichtliches: Enzym-Tests, bei denen NADP oder NAD eine Rolle
spielen, werden auch "optische Tests nach Warburg" genannt, weil Otto Warburg
diese Methode eingeführt hat. |
Das ist nur ein Beispiel. Viele andere Indikatorreaktionen,
auch zweistufige, sind bei Enzymanalysen in Verwendung.
Andere als photometrische Methoden zur Detektion des
Substratumsatzes (z.B. Fluorimetrische, Titrimetrische) werden im Routinelabor nicht
verwendet.
Die Messzeitpunkte: Fixed-Time oder
Continuous Monitoring
Um die Reaktionsgeschwindigkeit zu ermitteln, muss man das Ausmaß
der Veränderung (Zunahme des Produkts oder Abnahme des Substrats) in einem bestimmten
Zeitintervall bestimmen. Theoretisch reicht es, wenn man zwei Messpunkte hat. Die
Änderung der Extinktion dividiert durch die verstrichene Zeit sind dann ein Maß für die
Reaktionsgeschwindigkeit. So arbeiten die sog. Fixed-Time-Reactions bzw. Zweipunktmessungen
(manchmal fälschlich Endpunktmessung* genannt).
Vorzuziehen sind aber Continuous-Monitoring Methoden (Mehrpunktmessungen),
bei denen öfter gemessen wird. Aus dem Verlauf der Kurve, die man dabei erhält, kann man
besser erkennen, wenn mit der Analyse der Probe etwas nicht in Ordnung war.
*Das wäre schlecht, wenn bei der zweiten Messung schon der Endpunkt der Reaktion
erreicht wäre. Das hieße, dass die Reaktion schon vorbei war. Dann würde die Berechnung
der Geschwindigkeit nicht stimmen.
**Die Mehrpunktmessungen werden manchmal den Zweipunktmessungen als "kinetische
Methoden" gegenübergestellt. Das ist ungenau. Sowohl die Zweipunktmessung als auch
die Mehrpunktmessung werden vorgenommen solange die Reaktion noch läuft und man ermittelt
bei beiden eine Geschwindigkeit. Sie sind also beide "kinetische" Methoden
Einheiten
Zur Angabe der Enzymaktivität wird meist die Einheit IU/l
verwendet, also International Unit (Internationale Einheit) pro Liter
Serum.
Ein IU ist definiert als die Enzymaktivität bei der 1 µmol
Substrat in einer Minute unter Standardbedingungen umgesetzt wird.
Nicht durchgesetzt hat sich in der Medizin die SI-Norm Einheit
katal/l (kat/l). Sie beschreibt den Umsatz von 1 mol/sek. 1 kat/l ist eine extrem hohe
Enzymaktivität und entspräche 60 Millionen IU/l. Umgekehrt entspricht 1 IU 16.7
nkat/l (nanokatal/l).
Enzymreaktionen sind sehr empfindlich
An sich sind Messungen der Enzymaktivitäten heute in jedem Labor
zur Routine geworden und die Werte unterschiedlicher Labors kann man heute halbwegs
vergleichen. Der Weg dorthin war aber weit. Früher waren Werte unterschiedlicher Labors
kaum vergleichbar. Das lag an der großen Empfindlichkeit der Tests.
So wird die Enzymaktivität beeinflusst von der Reaktionstemperatur,
vom pH des Puffers aber auch von der Art des Puffers. Auch die Art des Substrates und
andere Testzusätze spielen eine Rolle. Und selbst das Ausmaß der Verdünnung des Serums
im Testansatz kann Einfluss auf das Ergebnis haben (damit ist natürlich ein über den
berechenbaren Verdünnungseffekt hinausgehender Einfluss gemeint).
Um dies in den Griff zu bekommen, haben die nationalen und
internationalen labormedizinischen Gesellschaften jahrzehntelang versucht, eine
Vereinheitlichung zu erreichen. Durch Vorgabe von Referenzmethoden, Empfehlung einer
Messtemperatur und durch Entwicklung von Referenzstandards (Proben mit genau definierter
Enzymaktivität).
|
|
|
|
 |
|
|
|
|
III.
Einsatz von Enzymen als Reagenzien in Labortests
A. Enzyme
in der "Routinechemie"
Eine wichtige Anwendung von Enzymen in der Labormedizin ist ihre
Verwendung zur Bestimmung von anderen Laborwerten.
Die Messung von Harnsäure im Blut
Dies sei anhand eines Beispiels dargestellt: Nehmen wir an, wir möchten die Konzentration
der Harnsäure im Blut bzw. im Serum messen (Harnsäure spielt bei der Erkennung der Gicht
eine Rolle).
Herkömmliche Reaktionen sind kompliziert und unspezifisch
So wie für viele andere Blutbestandteile gibt es auch für Harnsäure die Möglichkeit,
sie mit herkömmlichen Reagenzien zu bestimmen. So ergeben Harnsäure und
Phosphorwolframsäure unter geeigneten Bedingungen eine blaue Verbindung, die man im
Photometer messen könnte. Diese Methoden haben aber Nachteile: sie sind kompliziert und,
was noch schlimmer ist, sie sind meist nicht sehr spezifisch. Das heißt, eine
Farbreaktion entsteht nicht nur mit dem gewünschten Analyt sondern auch mit anderen
Stoffen. Es gibt also meist eine Reihe von Stoffen, die eine solche Farbreaktion stören
können. In Frage kommen z.B. körpereigene Störfaktoren oder Medikamente.
Enzyme sind spezifisch
Viele Enzyme reagieren hingegen nur mit einem ganz bestimmten Stoff, sind also
spezifisch. Andere Stoffe können da kaum mitreagieren und stören. Und für die
Harnsäure gibt es ein ideales Enzym, das ist die Uricase. Die Uricase baut Harnsäure ab.
Gibt man Uricase zum Serum dazu, wird die Harnsäure abgebaut. Da die Harnsäure bei 290
nm Licht absorbiert, kann man das glücklicher Weise im Photometer beobachten:
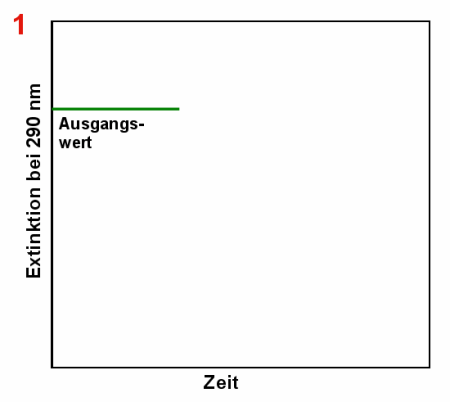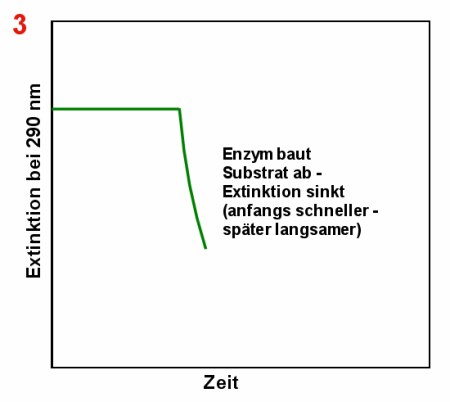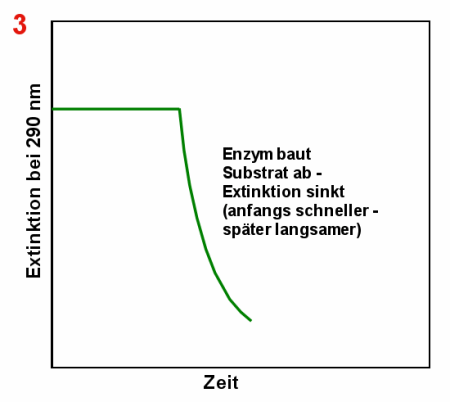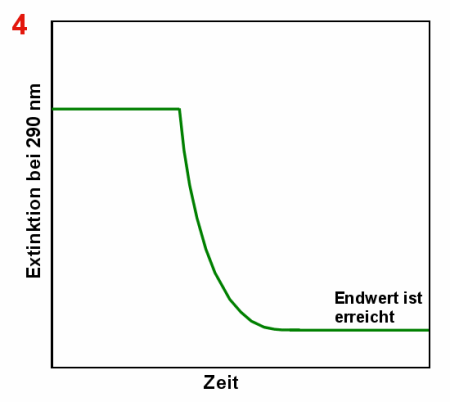 |
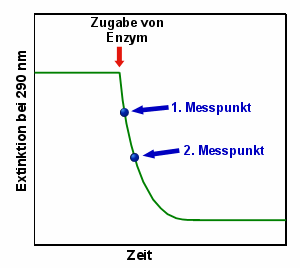
Abbau der Harnsäure durch Uricase Anfangs misst man eine relativ hohe Extinktion bei 290 nm (1). Nach
Zugabe der Uricase (2) nimmt die Harnsäurekonzentration und damit die Extinktion ab (3).
Irgendwann ist die ganze Harnsäure abgebaut und die Extinktion ändert sich nicht mehr
(4). |
Die Harnsäure ist jetzt abgebaut und wir haben es beobachtet. Wie
kommt man aber jetzt zur Harnsäurekonzentration. Da gibt es zwei Möglichkeiten.
- Die Endpunkt-Methode (korrekter: Äquilibrium-Methode)
Dabei lässt man die Reaktion wie oben beschrieben ablaufen. Man misst die Extinktion 2
Mal: Einmal den Ausgangswert vor Zugabe des Enzyms und nach Erreichen des Endwertes. Die
Differenz zwischen Ausgangswert und Endwert (multipliziert mit einem entsprechenden
Faktor) entspricht der Harnsäurekonzentration.
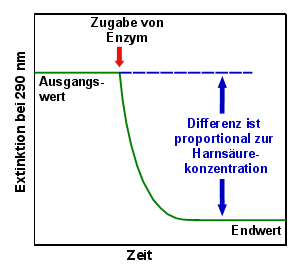 |
Endpunktmethode
Vorteile: Enzymmenge, pH, Reaktionstemperatur und selbst das Zeitintervall
müssen nicht so genau sein, solange man sicher ist, dass die Reaktion beim Endwert
angelangt ist, bevor man die 2. Messung durchführt.
Nachteile: Man braucht eine relativ große Enzymmenge, damit die Erreichung der
Endwertes nicht zu lange dauert.
|
- Kinetische Methoden
Diese haben folgende Grundlage: Unter geeigneten Bedingungen ist die Geschwindigkeit, mit
der das Substrat (z.B. die Harnsäure) abgebaut wird, proportional zur Menge vorhandenen
Substrats. Man kann damit aus der Geschwindigkeit des Abbaus, also aus der Steilheit des
Abfalls der Kurve, auf die Substratkonzentration schließen.
Wann soll man messen?
Die Konzentration des Substrats wird nach Zugabe des Enzyms laufend geringer. Wir
wollen aber die Ausgangskonzentration des Substrats ermitteln. Muss man daher die
Geschwindigkeit ganz am Anfang, gleich nach der Enzymzugabe messen? Nein. Man misst die
Extinktion 2 mal während die Reaktion läuft, also während des Abfalls der
Substratkonzentration. Mittels geeigneter mathematischer Formeln lässt sich aus der
Differenz der beiden gemessenen Extinktionen und der verstrichenen Zeit die
Ausgangskonzentration berechnen. Auch wenn man erst zu messen begonnen hat, als schon ein
Teil des Substrats abgebaut war.
 |
Kinetische Methode
Man misst die Reaktionsgeschwindigkeit durch 2-malige Messung der Extinktion in
einem definierten Zeitabstand. Aus diesen Ergebnissen lässt sich die
Ausgangskonzentration berechnen.
Vorteile: schnelle und genaue Messung, nur geringe Enzymmengen notwendig
Nachteile: Reaktionsbedingungen müssen unbedingt konstant gehalten werden. |
Endpunktmethoden benötigen andere
Enzyme als kinetische Methoden
Aus dem obigen Beispiel könnte man ableiten, dass bei
kinetischen und Endpunktmethoden prinzipiell die gleiche Reaktion abläuft und man daher
einen Test für beide Varianten einsetzen könnte. Wenn das auch theoretisch möglich
wäre, wäre es nicht ideal:
- Bei der Endpunktmethode möchte man eine möglichst rasche
komplette Umsetzung des Substrats erreichen, damit die Analyse nicht so lange dauert. Man
wird ein Enzym wählen, dass eine hohe Affinität ("Anziehungskraft") zum
Substrat hat. So sind möglichst viele Enzymmoleküle an der Umsetzung beteiligt und sie
ist schneller abgeschlossen.
[Die Größe, die die Affinität des Enzyms zum Substrat ausdrückt, ist die sog.
Michaelis-Konstante. Ist sie klein, ist die Affinität groß. Für Endpunktmethoden sucht
man also Enzyme mit niedriger Michaelis-Konstante.]
- Bei kinetischen Methoden ist das anders. Das Prinzip der
kinetischen Methode ist ja, dass die Reaktionsgeschwindigkeit der Substratkonzentration
proportional ist. Das ist aber nur dann gegeben, wenn die Enzymmoleküle nicht ausgelastet
sind. Sind einmal alle (oder die meisten) besetzt, dann führt eine Steigerung der
Substratkonzentration auch nicht mehr zu einer entsprechenden Steigerung der
Reaktionsgeschwindigkeit. Mehr geht dann nicht. Man muss also bei kinetischen Methoden
darauf achten, dass relativ wenig Enzymmoleküle besetzt sind. Auch wenn eine Menge
Substrat in der Probe sein sollte (was man ja vorher nicht weiß).
Daher verwendet hierfür Enzyme mit einer eher niedrigen Affinität zum Substrat, also mit
einer hohen Michaelis-Konstante.
Indikatorreaktionen können notwendig sein
Nicht immer gibt es bei der Reaktion des Enzyms mit dem Substrat
etwas, was man im Photometer beobachten könnte. Dieses Problem stellt sich z.B. bei der
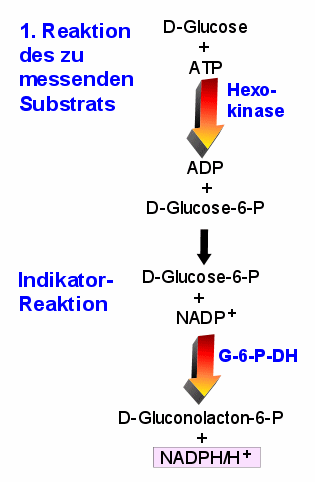
Blutzuckerbestimmung. Zwar wird Glucose mit Hilfe des Enzyms Hexokinase umgesetzt, aber
weder die Glucose noch das Produkt, das Glucose-6-Phosphat noch die beteiligten Kofaktoren
ATP und ADP sind photometrisch messbar. Also schließt man eine zweite Reaktion an:
Vermittelt durch das Enzym G-6-P-Dehydrogenase entsteht aus dem Glucose-6-Phosphat das
D-Gluconolacton-6-Phosphat und NADPH/H+. Letzteres kann man photometrisch messen.
 |
Das Ganze hat noch einen anderen wichtigen Aspekt: Das
erste Enzym, die Hexokinase, würde auch mit anderen Zuckern reagieren, z.B. mit Fructose.
Es ist also nicht ausreichend spezifisch für Glucose. Das Enzym der Indikatorreaktion,
die G-6-P-Dehydrogenase ist aber spezifisch, es reagiert nur mit Glucose-6-Phosphat nicht
aber mit z.B. Fructose-6-Phosphat. Somit dient die Indikatorreaktion in diesem Fall nicht
nur dem Anzeigen des Vorgangs sondern auch der Spezifität der Messung. |
Manche Produkte muss man beseitigen
Lactat wird im Blut bestimmt, um die Leistungsgrenzen von Sportlern
festzustellen. Eine Erhöhung kann aber auch Ausdruck verschiedener Krankheiten sein (z.B.
Schock oder Darmgefäßverschluss). Und Lactat lässt sich prinzipiell mit folgender
enzymatischen Reaktion gut erfassen: Unter dem Einfluss des Enzyms Lactat-Dehydrogenase
entsteht aus dem Lactat (unter Verbrauch von NAD+) Pyruvat und NADH/H+. Und das NADH/H+
lässt sich photometrisch messen.
Das Problem bei dieser Reaktion ist, dass sie auch in die andere Richtung läuft, sich
also das Pyruvat wieder zum Lactat umwandelt. Besser gesagt: Das Gleichgewicht bei dieser
Reaktion ist nicht klar auf der Seite der Produkte, wie es bei enzymatischen
Nachweisreaktionen sein sollte.
Die Lösung ist, das Pyruvat mit einer zweiten Reaktion zu entfernen. Dann kann es sich
nicht mehr rückumwandeln.
Das funktioniert z.B. mit dem Stoff Hydrazin, der mit Pyruvat unwiderruflich zum Hydrazon
reagiert. Oder man entfernt das Pyruvat mit Hilfe eines 2. Enzyms, der
Alanin-Aminotransferase. |
|
|
|
 |
|
B.
Enzyme als Indikatoren in der Immunchemie
Allgemeines
Antikörper werden für Laboranalysen eingesetzt
In der Immunchemie werden verschiedenste Strukturen mit Hilfe von Antikörpern
nachgewiesen, die gegen diese Strukturen gerichtet sind. Nachweisen kann man z.B.
Krankheitserreger, Tumormarker im Blut oder auch Tumorzellen im Mikroskop. Aber auch
Antikörper, die wir selbst z.B. gegen Krankheitserreger bilden, kann man mit geeigneten
Ansätzen nachweisen.
Grundlage der Reaktion ist immer, dass sich der Antikörper auf das passende Antigen
setzt. Anschließend muss man die Reaktion sichtbar machen. Dazu gibt es unterschiedliche
Möglichkeiten. Eine wichtige davon ist die Markierung mit Enzymen.
Das Enzym zeigt die Antikörperbindung an und verstärkt sie
Eine Markierung mit Enzymen könnte man so durchführen: Man koppelt ein Enzym an einen
Antikörper. Der Antikörper setzt sich auf die nachzuweisende Struktur. Anschließend
muss man den überschüssigen Antikörper, der nicht an die nachzuweisende Struktur
gebunden ist, entfernen. Dann gibt man ein Substrat dazu, aus dem durch die Enzymwirkung
ein farbiges Produkt entsteht. Dieses kann man dann im Photometer messen. Und da ein
Enzymmolekül Zig-Tausende Farbmoleküle erzeugen kann, ist dies nicht nur eine Nachweis-
sondern auch eine wichtige Verstärkerreaktion.
ELISA
Sehr verbreitet sind im Labor die sog. ELISA-Tests. ELISA steht für
Enzyme-Linked-Immuno-Sorbent-Assay.
Diese existieren in unzähligen Varianten. Eine Möglichkeit ist in der Abbildung
dargestellt:
|
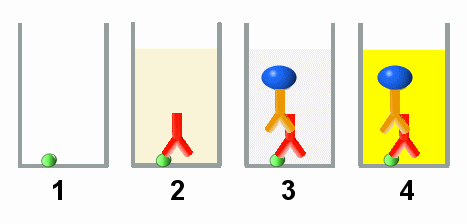
Beispiel eines ELISA zum Nachweis von
Hepatitis-Antikörpern im Serum
1. Gefäß mit am Boden fixiertem Antigen (z.B. Teil des Hepatitis-Virus)
2. Zugabe von Serum. Sind im Serum Antikörper gegen Hepatitis-Viren, werden sich diese
auf das Antigen setzen (roter Antikörper).
3. Nach Herauswaschen des Serums wird Enzym-gekoppelter Markierungs-Antikörper (brauner
Antikörper) zugegeben. Dieser Antikörper bindet an menschliche Antikörper, daher auch
an den roten Hepatitis-Antikörper.
4. Jetzt muss wieder ein Waschschritt erfolgen, denn überschüssiger
Markierungs-Antikörper (nicht eingezeichnet) muss unbedingt entfernt werden. Danach gibt
man ein Substrat dazu, das vom Enzym in einen gelben Farbstoff umgewandelt wird. Die
Gelbfärbung ist der Nachweis, dass im Serum Hepatitis-Antikörper vorhanden waren. |
 |
ELISA in einer Mikrotiterplatte
So könnte das in der Praxis aussehen. In einer sog. Mikrotiterplatte sind 96
kleine Gefäße bzw. Näpfchen. Am Boden der Näpfchen kann das Antigen fixiert sein.
Zugabe der Reagenzien erfolgt meist händisch, das Waschen und Ablesen in einem speziellen
Gerät. |
Enzym-unterstützte Analyse von
mikroskopischen Gewebspräparaten - Immunhistochemie
Zur Analyse von Geweben (z.B. Tumorgewebe) werden diese in ganz
dünne Scheiben geschnitten, gefärbt und im Mikroskop untersucht. Aber nicht alles kann
man nach einer einfachen Färbung im Mikroskop erkennen. Da kann es helfen, mit
Antikörpern ganz bestimmte Strukturen, die für bestimmte Erkrankungen typisch sind, zu
markieren. Wieder braucht man zum Sichtbarmachen eine Nachweisreaktion. Und die kann z.B.
mit Enzym-gekoppelten Antikörpern erfolgen. Dann gibt man noch eine Flüssigkeit mit
Substrat dazu, das vom Enzym in einen Farbstoff umgewandelt wird. Schon hat man die
Antikörper-markierte Region im Mikroskop sichtbar gemacht.
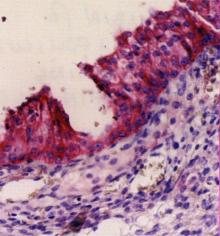 |
Beispiel einer immunhistochemischen,
Enzym-vermittelten Färbung
Nachweis des sog. Inhibins, das man in der normalen Mikroskopie nicht erkennen
würde, in einer Gewebsprobe. Zuerst wurde der Antikörper gegen Inhibin dazugegeben,
danach wurde er mit einem Enzym gekoppelt. Dann wurde ein Farbstoff dazugegeben, der seine
rote Farbe erst unter Enzymeinfluss entwickelt. Daher sind nur die Zellen, die Inhibin
enthalten, rot gefärbt.
Nach einer Darstellung der Fa. Serotec. |
|
|
|
|
 |
|
C.
Einsatz von Enzymen in Biosensoren
Enzyme werden definitionsgemäß bei Reaktionen nicht verbraucht.
Dennoch ist bei herkömmlichen Verfahren (z.B. der normalen Blutzuckermessung im Labor)
eine Wiederverwendung nicht möglich. Man vermischt ja das Enzym mit der Probe und kann es
anschließend nicht mehr einfach wiedergewinnen. Das relativ teure Enzym muss daher
verworfen werden.
Diese und andere Gründe haben die Entwicklung nach alternativen
Methoden zum Einsatz von Enzymen inspiriert.
Enzyme werden auf Membran fixiert
Grundsätzlich wollte man dabei das Enzym nicht verlieren. Man bindet es dazu an spezielle
Membranen. Und anstatt es mit der Probe zu vermischen, bringt man es nur mit der Probe
zusammen. Und zwar durch eine Trennmembran, die der zu analysierende Stoff durchdringen
kann.
Die Reaktion wird mit Elektroden sichtbar gemacht
Der zu analysierende Stoff dringt zur Enzym-beladenen Membran vor und reagiert. Aber diese
Reaktion muss man noch sichtbar bzw. messbar werden. Eine in der Routinechemie übliche
Färbereaktion anzuschließen, wäre unpraktisch. Bei Biosensoren wählt man
Reaktionssysteme, bei denen die durch die Enzymwirkung ausgelöste Reaktion mit Hilfe von
Elektroden messbar ist.
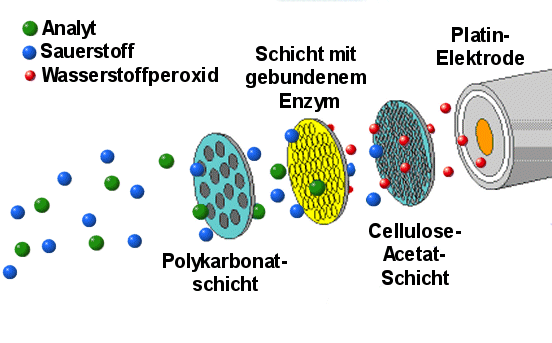
|
Schema eines Biosensors (modifiziert nach Unterlagen
der Firma YSI)
Wird der Biosensor mit Serum zusammen gebracht, gelangt der Analyt (=der Stoff, den man
messen will) durch die Polykarbonat-Schicht zur Enzymschicht. Dort reagiert er unter
Bildung von Wasserstoffperoxid (H2O2). Dieses gelangt durch die
Celluloseacetat-Schicht und kann dann mittels Platinelektrode gemessen werden. Die Firma
YSI bietet z.B. Glucose-, Alkohol und Lactat-empfindliche Sensoren an, die nach diesem
Prinzip funktionieren.
Es gibt aber zahllose andere Varianten, bei denen Enzyme in vergleichbarer Form eingesetzt
werden. |
Die eingangs erwähnte Reagenzersparnis steht bei vielen
Anwendungen der Biosensoren im Hintergrund. Die einfache Messbarkeit von Substanzen mit
Hilfe eines Messfühlers, den man nur in die zu analysierende Flüssigkeit eintauchen
muss, ermöglicht neue Einsatzmöglichkeiten.
|
|
|
|
 |
|
|
|
|
IV.
Grundlagen der Enzymkinetik Die
Grundlagen der Enzymkinetik stehen oft am Anfang eines Kapitels über Enzyme und sind der
Grund, warum man das Kapitel dann nicht zu Ende liest. Wir haben das Thema daher bewusst
ans Ende gestellt und beschränken uns auf das Nötigste.
 |
Michaelis-Menten-Graph
Abhängigkeit der Reaktionsgeschwindigkeit von der Substratkonzentration (bei konstanter
Enzymkonzentration).
Anmerkung: Diese Kurve gilt für viele aber nicht für alle Enzym-vermittelten
Reaktionen. In biologischen Systemen ist oft eine sigmoide Kurve
zu beobachten. |
Die Michaelis-Menten Kurve beschreibt, wie hoch die
Reaktionsgeschwindigkeit bei verschiedenen Substratkonzentrationen ist. Man sieht, dass
mit steigender Substratkonzentration auch die Reaktionsgeschwindigkeit steigt. Am Anfang
recht steil. Später wird die Kurve flacher, der Anstieg geringer. Es kommt zu einer
Sättigung des Enzyms mit Substrat, die Geschwindigkeit lässt sich nicht (bzw. kaum) mehr
weiter steigern. Die Maximalgeschwindigkeit wird zwar theoretisch nie erreicht, praktisch
gesehen ist man ihr aber bei großem Substratüberschuss sehr nahe.
Die Gleichung nach Michaelis-Menten
Michaelis und Menten haben eine Funktion eingeführt, die oben
dargestellte Kurve beschreibt:
|
| Dabei ist: |
| v die Reaktionsgeschwindigkeit |
| Vmax die maximale Reaktionsgeschwindigkeit |
| S die Substratkonzentration und |
Km die sog. Michaelis-Konstante
(wird später erklärt, vorerst einmal:
irgendeine für das Enzym/Substrat-Paar typische Konstante) |
Interessant an dieser Funktion sind folgende
Situationen:
- Substratüberschuss
Ist S sehr groß, viel größer als Km, dann kann man Km vernachlässigen und die Formel
heißt:
(bitte statt der einfachen Wellenlinie eine doppelte vorstellen)
|
|
|
Vmax |
x |
S |
|
|
|
|
| v |
~ |
|
|
S/S ist 1, daher |
v ~ Vmax |
|
|
|
|
|
S |
|
|
|
|
Das deckt sich mit unseren Überlegungen: Bei hoher
Substratkonzentration ist das vorhandene Enzym gesättigt und die maximale
Reaktionsgeschwindigkeit wird erreicht.
Im Substratüberschuss, also in der Enzymsättigung, hält man die Bedingungen beim
Nachweis von Enzymen im Blut. Da will man ja, dass die Reaktionsgeschwindigkeit nur mehr
von der Enzymkonzentration abhängt, denn die will man ja bestimmen. Und das ist bei
Substratüberschuss der Fall.
- Geringe Substratkonzentration
ist S sehr klein, viel kleiner als Km, dann kann man das S im Nenner vernachlässigen und
die Formel heißt
Nun ist aber Vmax konstant (bei konstanter
Enzymkonzentration), Km ist sowieso eine Konstante, man kann also sagen in diesem Fall
gilt
v ~ K x S
K steht für "irgendeine Konstante". Wichtig ist, dass in diesem Fall, also wenn
S viel niedriger als Km ist, die Reaktionsgeschwindigkeit von der Substratkonzentration
abhängt.
Diese Bedingungen trifft man oft in biologischen Regelkreisen, im Stoffwechsel. So
ist gewährleistet, dass mehr Substrat verarbeitet wird, wenn mehr Substrat anfällt. Ein
Beispiel ist die Glucoseumwandlung durch die Glucokinase der Leber. Deren Km liegt bei ca.
270 mg/dl, der Blutglucosespiegel aber etwa bei 80 mg/dl, also deutlich unter Km.
Nach Mahlzeiten steigt die Glucosekonzentration im zur Leber kommenden Blut auf
400 mg/dl oder mehr an, also über die Km. Dadurch steigt auch die
Reaktionsgeschwindigkeit und damit die Verwertung/Speicherung der Glucose in der Leber.
Aber auch bei labormedizinischen Tests, und zwar bei den bei den enzymatischen Messungen
von Substraten mit kinetischen Methoden arbeitet man in diesem Bereich (siehe oben).
- S = Km
Eine dritte Situation ist noch interessant: Wenn die Konzentration des Substrats gleich
der Michaelis-Konstanten Km ist.
Es wurde noch nicht erwähnt, aber die Michaelis-Konstante hat die Dimension einer
Konzentration (die Substratkonzentration natürlich auch). Ist S gleich Km, dann gilt:
|
|
|
Vmax |
x |
Km |
|
|
|
Vmax |
x |
Km |
|
|
|
|
Vmax |
|
| v |
= |
|
= |
|
|
= |
|
|
|
|
Km |
+ |
Km |
|
|
|
2 |
x |
Km |
|
|
|
|
2 |
|
Das heißt, wenn S gleich Km, dann läuft die Reaktion mit
halber Maximalgeschwindigkeit. Und jetzt kommen wir auch endlich zu einer Beschreibung der
Michaelis-Konstante.
| Die Michaelis-Konstante ist die Substratkonzentration, bei
der die Enyzmreaktion mit halbmaximaler Reaktionsgeschwindigkeit abläuft. |
Die Michaelis-Konstante ist eine Eigenschaft
des Enzyms (bezogen auf ein bestimmtes Substrat)
- Eine hohe Michaelis-Konstante zeigt eine niedrige Affinität
des Enzyms zum Substrat.
Das ist aufs Erste verwirrend aber: Eine hohe Michaelis-Konstante heißt ja, dass erst bei
relativ hohen Substratkonzentrationen die halbmaximale Reaktionsgeschwindigkeit erreicht
ist. Das Enzym ist offensichtlich nicht sehr bindungsfreudig.
- Eine niedrige Michaelis-Konstante zeigt eine hohe Affinität
des Enzyms zum Substrat.
Eine niedrige Michaelis-Konstante heißt, dass schon bei relativ niedrigen
Substratkonzentrationen die halbmaximale Reaktionsgeschwindigkeit erreicht ist. Das Enzym
ist offensichtlich bindungsfreudig.
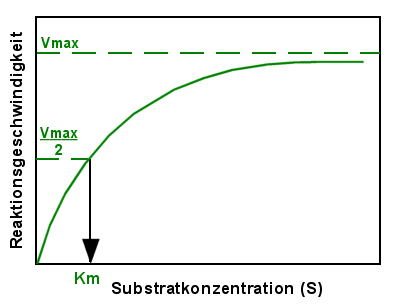 |
Michaelis-Menten-Graph mit eingezeichneter
Michaelis-Konstante
Für die meisten Enzyme liegt die Michaelis-Konstante zwischen 10-5 und
10-3 mol/l also zwischen 10 und 1000 µmol/l. |
Wie ermittelt man die Michaelis-Konstante?
Dazu muss man zuerst ein paar Versuche machen und die
Reaktionsgeschwindigkeit bei verschiedenen Substratkonzentrationen messen. Die ermittelten
Reaktionsgeschwindigkeiten kann man gegen die Substratkonzentrationen auftragen, was so
aussehen könnte:
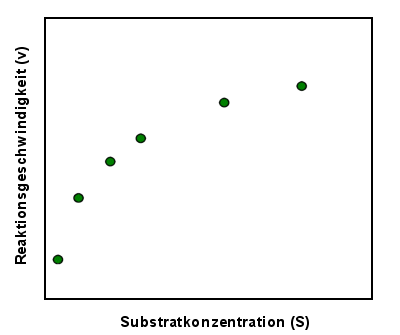 |
Ergebnisse nach 6 Testansätzen mit 6 verschiedenen
Substratkonzentrationen (bei konstanter Enzymkonzentration) |
Und man könnte an diese Punkte jetzt so gut es geht eine Kurve anpassen, die
Maximalgeschwindigkeit erahnen und bei der halben Maximalgeschwindigkeit die
Michaelis-Konstante ablesen:
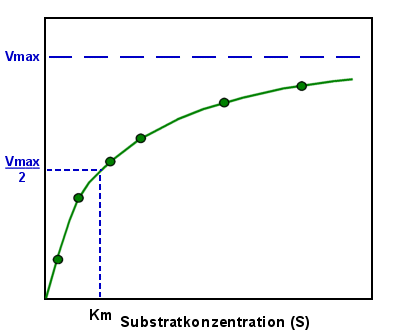 |
Ermitteln der Michaelis-Konstante Km
Durch Einzeichnen und Extrapolieren ("Verlängern") der Kurve
kann man die Maximalgeschwindigkeit Vmax erahnen. Dadurch hat man natürlich auch Vmax/2.
Unter dem Schnittpunkt von Vmax/2 mit der Kurve kann man Km ablesen. |
Das Einzeichnen und Extrapolieren einer solchen Kurve ist
nicht ideal. Wäre das ganze eine Gerade, wäre es leichter. Und tatsächlich kann man die
Michaelis-Menten-Gleichung so umformen, dass eine Geradengleichung daraus wird:
|
1 |
|
|
|
Km |
|
|
|
1 |
|
|
|
|
1 |
|
|
= |
|
x |
|
|
+ |
|
|
v |
|
|
|
Vmax |
|
|
|
S |
|
|
|
|
Vmax |
|
Wie man zu der Gleichung kommt, kann uns egal sein, es ist
eine Art Kehrwertbildung. Sie heißt jedenfalls Lineweaver-Burk-Gleichung und die
entsprechenden Diagramme heißen Lineweaver-Burk Diagramme und die verwenden wir einfach:
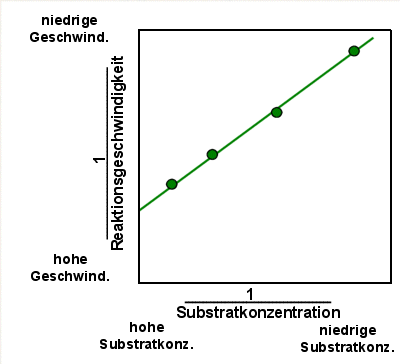 |
Lineweaver-Burk Diagramm 1
Man trägt hier immer die Kehrwerte ein. Das ist etwas ungewohnt. Man
findet z.B. auf der X-Achse rechts die niedrigen Substratkonzentrationen, während links
die hohen Substratkonzentrationen sind.
Das wichtigste ist aber deutlich erkennbar: es entsteht eine Gerade. |
Aber wo liest man jetzt die Ergebnisse ab? Wir wollen ja Vmax
bestimmen, dann Vmax/2 und die Michaelis-Konstante Km.
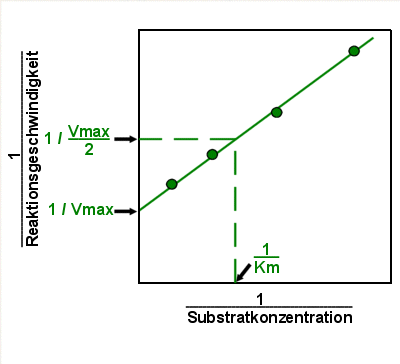 |
Lineweaver-Burk Diagramm 2
Vmax findet man bei unendlich hoher Substratkonzentration (bei kompletter
Enzymsättigung). Das ist auf der X-Achse ganz links (wenn die Substratkonzentration S
unendlich ist, ist 1/S null). Vmax ist also im Schnittpunkt der extrapolierten Geraden mit
der Y-Achse abzulesen. Vmax/2 liegt auf der Y-Achse doppelt so hoch wie Vmax (Kehrwerte!).
Hat man Vmax kommt man leicht auf 1/Km (strichlierte Linie). Der Kehrwert davon ist Km. |
In der Praxis macht man es sich noch etwas einfacher:
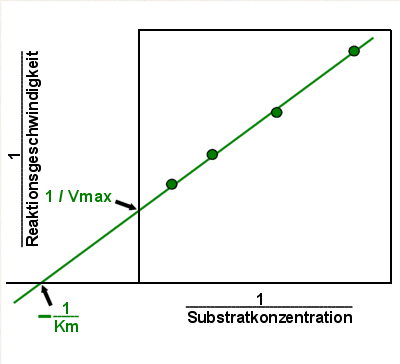 |
Typisches Lineweaver-Burk Diagramm
Wenn man die Gerade einfach in den (irrealen) Negativbereich verlängert
kann man im Schnittpunkt der Geraden mit der X-Achse den negativen Kehrwert von Km
ablesen. |
Die verschiedenen Arten der Enzymhemmung
Es sollen hier nur die zwei Hauptmechanismen näher beschrieben
werden, die kompetitive und die nicht-kompetitive Hemmung.
- Die kompetitive Hemmung
Bei der kompetitiven Hemmung gibt es einen Wettstreit des Substrates mit einem anderen
Stoff um die Bindungsstellen am Enzym. Gibt man Substrat im Überschuss dazu, dann
"gewinnt" das Substrat diesen Wettbewerb, dann spielt der Störfaktor kaum eine
Rolle. D.h. die erreichbare Maximalgeschwindigkeit Vmax ist bei der kompetitiven Hemmung
unbeeinflusst, man braucht nur genug Substrat zu verwenden.
Die andere Kenngröße einer Enzymwirkung, die Michaelis-Konstante Km, wird aber erhöht
sein. Weil sich das Enzym nicht mehr so leicht an das Substrat binden wird. Da spielt die
Konkurrenz des Störfaktors eine Rolle.
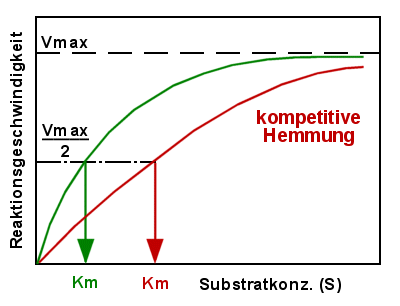 |
Kompetitive Hemmung
- Vmax unverändert
- Km erhöht
|
- Die nicht-kompetitive Hemmung
Dabei besitzt der hemmende Stoff keine Ähnlichkeit mit dem Substrat und konkurriert auch
nicht mit dem Substrat um die Bindung an das Enzym. Der Hemmstoff wirkt an einer anderen
Stelle des Enzyms und verlangsamt die Reaktion zum Produkt. Bei der rein
nicht-kompetitiven Hemmung ist die Michaelis-Konstante unverändert, nur Vmax ist
vermindert.
Reine nicht-kompetitive Bindungen sind selten, da eine Bindung eines Stoffes an ein
Enzym oft auch Auswirkungen auf das aktive Zentrum und damit die Substratbindung haben
wird.
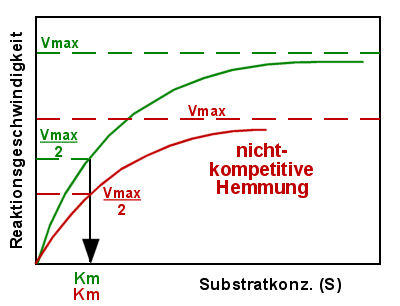 |
Nicht-Kompetitive Hemmung
- Vmax vermindert
- Km unverändert
|
- Mit der eigenartigen Bezeichnung "unkompetitive
Hemmung" (uncompetitive inhibition) beschreibt man eine Hemmung, bei der der
hemmende Stoff sich erst dann ans Enzym binden kann, wenn dieses bereits das Substrat
gebunden hat. Auch hierbei ist Vmax verringert, die Michaelis-Konstante kann eigenartiger
Weise ebenfalls vermindert sein.
Mischformen zwischen verschiedenen Hemmformen kommen
selbstverständlich vor.
"Sigmoide"
Enzyme
Die schon mehrfach erwähnte Michaelis-Menten-Kurve beschreibt für
viele Enzym-vermittelten Reaktionen den Zusammenhang zwischen Substratkonzentration und
Reaktionsgeschwindigkeit. Aber nicht für alle Enzyme gilt dieser Zusammenhang, für
manche sieht die Kurve anders aus. Eine wichtige Variante ist der sigmoide Kurvenverlauf
mancher Enzyme:
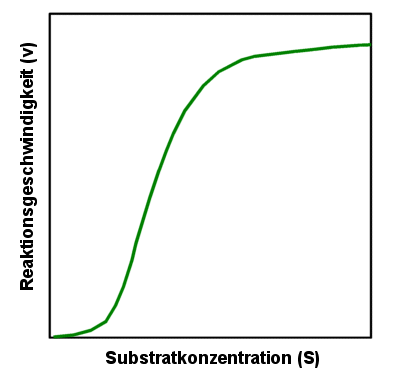 |
Sigmoide Kurve eines Enzyms
Anfangs reagiert die Reaktionsgeschwindigkeit nur wenig auf steigende
Substratkonzentrationen. Ab einer bestimmten Konzentration aber steigt die Geschwindigkeit
plötzlich rasch an und ist sehr bald nahe der maximalen Geschwindigkeit. |
Eine solche Kurve ergibt sich für Enzyme, die aus mehreren
Untereinheiten bestehen. Jede Untereinheit hat ein aktives Zentrum. Der sigmoide Effekt
kommt dann zu Stande, wenn die Bindung des Substrats an einer Untereinheit die Bindung des
Substrats an der anderen Untereinheit erleichtert. Man nennt das dann auch positive
Kooperativität, weil die Untereinheiten sich gegenseitig unterstützen.
Eine solches Verhalten wird dann günstig sein, wenn schon kleine Änderungen der
Substratkonzentration große Änderungen der Reaktionsgeschwindigkeit auslösen sollen. |
|
|
|
 |



