Beim
Nachweis von Analyten (Laborwerten) mit Antikörpern kann es zu paradox niedrigen Werten kommen. Mit
paradox ist gemeint, dass bei steigenden Konzentrationen ab einer
gewissen Analytkonzentration das Ergebnis
nicht nur nicht mehr steigt sondern sogar noch niedriger wird,
wenn die Konzentration noch höher steigt.
Zum besseren Verständnis ein Vergleich mit
einem Tachometer beim Auto, der nur bis 180 km/h anzeigen kann.
Niemanden wird es verwundern, dass er auch dann nur 180 km/h
anzeigt, wenn man 200 oder 250 km/h fährt. Bei immunologischen Tests
kann es aber noch schlimmer kommen: es kann sein, dass - auf das
Tachometer-Beispiel übertragen - der Tacho bei 180 km/h noch 180
km/h anzeigt, bei 200 km/h nur mehr 150 km/h und, wenn man 250 km/h
fährt, zeigt der Tacho vielleicht nur mehr 50 km/h an.
Leider gibt es dieses Phänomen
auch bei modernen Tests immer noch. Wenn es im Labor übersehen
wird, kann es zu absurden Resultaten führen: eine enorme
Konzentration eines Laborwerts wird dann übersehen und als sehr
niedrige Konzentration ausgegeben.
Ursache des Problems
Technisch-methodisch gesehen,
hat das Phänomen bei den verschiedenen Varianten
immunologischer Tests verschiedene Ursachen. Das Gemeinsame ist,
dass der zu messende Analyt im Überschuss vorliegt, dass also nicht
genug Antikörper gegen den Analyt im Reagenz ist, und dass die
Ergebnisse bei steigenden Konzentrationen wieder niedriger werden.
Man hat den
Effekt als "Artefakt bei Antigen-Excess" oder "High-Dose-Hook-Effekt"
bezeichnet bzw. bei
früheren Tests mit der "Heidelberger-Kendall-Kurve" beschrieben.
Beispiel: Paradox niedrige Werte bei zu hohen Konzentrationen des Analyts
(Antigenüberschuss) bei einem
Sandwich-Magnet-Immunoassay.
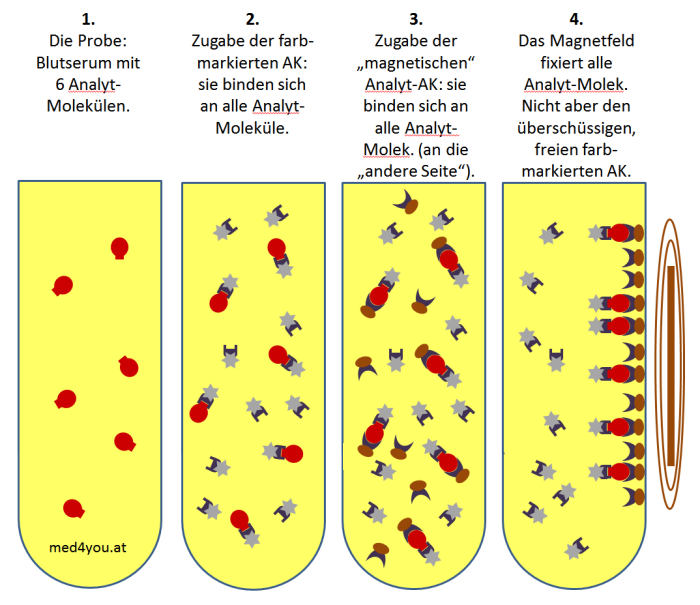
Wie es funktionieren sollte - Das Testprinzip
Bei einem Sandwich-Assay muss das Analyt-Molekül von 2 verschiedenen Antikörpern gebunden werden (das
passiert an zwei verschiedenen Bindungsstellen des Analyt-Moleküls). Und es müssen
BEIDE Antikörper an DASSELBE Analyt-Molekül binden, damit er gemessen wird.
Der
eine Antikörper hängt in unserem Beispiel eine Farbmarkierung an den
Analyt an (Schritt 2 in untenstehender Abbildung). Man muss diesen ersten Antikörper im
Überschuss zugeben, damit alle Analytmoleküle markiert sind.
Der
zweite Antikörper trägt ein winziges Magnet-Partikel. Er bindet das Analyt-Molekül
wie erwähnt "auf der anderen Seite" (Schritt 3). Auch dieser Antikörper muss im
Überschuss vorhanden sein, er sollte an alle vorhandenen
Analytmoleküle binden.
Im Normalfall liegen jetzt also alle
Analyt-Moleküle als "Sandwiches" vor: in der Mitte das Analyt-Molekül,
auf der einen Seite der Markierungsantikörper auf der anderen der
"Magnet-"Antikörper.
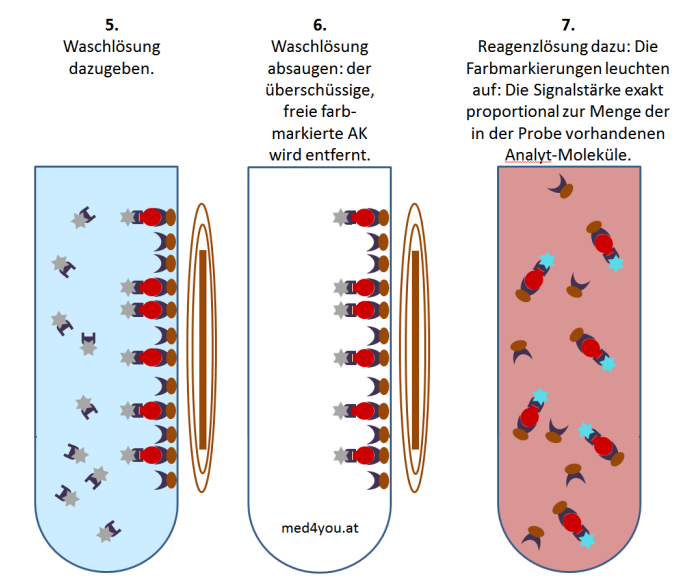
Jetzt werden alle "Magnet-Antikörper" und damit auch alle
Sandwiches durch Anlegen eines Magnetfeldes an der Röhrchenwand
festgehalten (Schritt 4). Man kann nun die überschüssigen Markierungsantikörper
problemlos wegwaschen (Schritte 5 und 6). Jetzt wird noch eine Reagenzlösung dazu geben,
die die Farbmarkierung zum Leuchten bringt (Schritt 7). Dieses
Leuchten misst man und kann daraus die Analyt-Konzentration
errechnen.
|
Die verschiedenen Schritte einer Sandwich
Immunoassay-Analyse mit Magnet-Partikeln
|
|
|
|
|
Wichtig: In der Realität erfolgen Schritt 2 und 3
gleichzeitig, d.h. man gibt den farbmarkierten Antikörper und den
Magnetteilchen-tragenden Antikörper praktisch gleichzeitig dazu. Man nennt das
deswegen auch einen einstufigen Immuno-Assay. |
Warum es manchmal nicht funktioniert - Der High-Dose-Hook-Effekt bei Antigenüberschuss: Erklärung in Worten
Sind beide Antikörper in
geringerer Konzentration als der Analyt vorhanden, dann werden nicht
alle Analyt-Moleküle zu "Sandwiches". Manche Analyt-Moleküle werden nur einen
Markierungsantikörper binden, manche nur einen Magnet-Antikörper.
Diese Analyte werden beide nicht gemessen. Nur manche
Analyt-Moleküle werden zufällig
doch beide Antikörper gebunden haben und können dann auch gemessen
werden.
Sind jetzt noch mehr Analyt-Moleküle in der Probe, dann
werden es noch weniger Analyt-Moleküle sein, die zufällig beide Antikörper gebunden haben
und so gemessen werden. D.h., je mehr Analyte in der Probe sind,
desto weniger werden gemessen: der paradoxe High-Dose-Hook-Effekt - je
höher die Analytkonzentration desto geringer wird das Ergebnis.
Der High-Dose-Hook-Effekt bei Antigenüberschuss, Erklärung in Bildern
Vielleicht wird das Problem durch Grafiken verständlicher:
A. Wenn gerade
noch ausreichend Antikörper vorhanden ist:
Wir messen das Signal in der "Leuchtstärke" 6.
B. Wenn doppelt so viel Analyt wie Antikörper in der Probe ist
und damit ein Antigenüberschuss vorliegt:
Wir messen das Signal in
der "Leuchtstärke" 3.
C. Wenn noch mehr Analytmoleküle in
der Probe sind und damit ein noch stärkerer Antigenüberschuss vorliegt
Wir messen das Signal in der "Leuchtstärke" von vielleicht nur
mehr 1.
Je mehr Analytmoleküle in der Probe, desto
unwahrscheinlicher, dass an einen Analyt beide Antikörper binden,
desto niedriger das Signal.
Spielt der
High-Dose-Hook-Effekt in der Praxis noch eine Rolle?
Ja,
leider schon. Auch moderne Tests haben das Problem. Erst 2014
publizierte T. Bertsch aus Nürnberg Beispiele dafür. Auch als
Warnung für Labors und Kliniker. Er hat den Tumormarker AFP in
steigenden Konzentrationen mit 3 modernen Immunoassays gemessen. Zwei
davon zeigten den Effekt ganz deutlich: bei hohen
AFP-Konzentrationen ist das Ergebnis dieser Tests wieder gefallen.
So bekam man bei der enormen Konzentration von 2 Millionen (!) ng/ml
nur mehr ca. 500 ng/ml heraus (Bertsch T., Clinical Laboratory, 2014;
60:1585-1586).
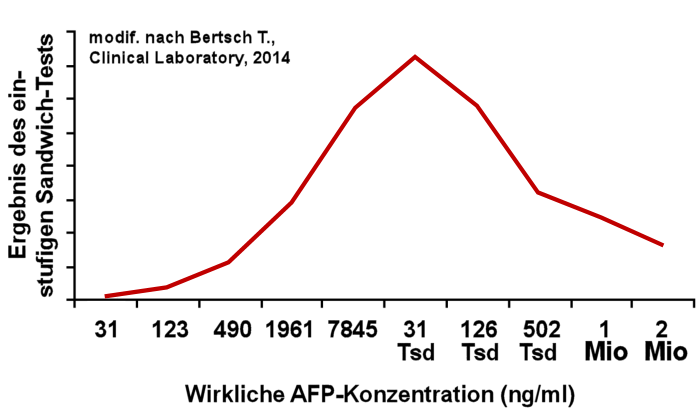
Jetzt wird auch der Name "High-Dose-Hook-Effekt" verständlicher:
die Kurve sollte ja bei steigenden Konzentrationen weiter nach oben
und nicht nach unten gehen. Zumindest könnte sie auf hohem Niveau in
einer Art Sättigung bleiben, dann ist der Wert zwar immer noch
falsch aber nicht irreführend niedrig. Aber nein, es kommt noch
schlimmer, die Kurve macht
bei hohen Konzentrationen einen "Haken" nach unten.
Was kann man gegen
den High-Dose-Hook-Effekt tun?
Daran denken
Erst einmal ist es schon wichtig zu wissen, dass
es so etwas gibt. Wenn man ein unplausibel niedriges Resultat eines
immunologischen Tests bemerkt, z.B. weil der Vorwert des
Patienten viel höher lag. Dann kann man dem nachgehen. Im Labor kann
man dann die Probe verdünnen. Wenn nach der Verdünnung paradoxer
Weise mehr herauskommt als vorher, könnte das niedrige Erstergebnis durch einen
High-Dose-Hook-Effekt verursacht gewesen sein.
Für breiten
Messbereich sorgen
Der Testhersteller kann dafür sorgen, dass der
Test ausreichend Antikörper für einen sehr breiten Messbereich hat.
Das ist aber leider nicht immer möglich.
Abnormen Testverlauf
erkennen
Bei manchen Tests kann auch der Testverlauf
während der Messung beobachtet werden (z.B. bei nephelometrischen
Tests). Wenn dieser Verlauf abnorm ist, kann das ein Hinweis auf
einen Antigenüberschuss sein. Dann wird zum Ergebnis eine
entsprechende Warnung ausgegeben. Man muss die Probe dann verdünnen
und noch einmal analysieren. Leider werden diese Warnungen auch
nicht zu 100% verlässlich ausgegeben.
Jede Probe verdünnt und
unverdünnt analysieren
Dann würde man einen High-Dose-Hook Effekt
bemerken. Meist ist dies aber nicht praktikabel, kostet viel Zeit und Geld.
Immer vorab verdünnen
Man kann natürlich auch jede Probe schon vor der ersten Analyse so
stark verdünnen, dass ein Antigenüberschuss gar nicht möglich ist.
Dann wird man aber bei der ersten Analyse bei vielen Proben
unter der Nachweisgrenze des Tests liegen und kein Resultat
bekommen. Dann muss man die Probe noch einmal unverdünnt messen. Das
kostet auch viel Zeit und Geld. Es ist daher nicht für alle Analyte
praktikabel. Bei ganz wenigen muss man aber so vorgehen.
Einen Test verwenden, der das Problem nicht hat
Jeder Test hat
eine obere Messbereichsgrenze. Liegt die Konzentration der Probe
darüber, wird der Wert nicht mehr stimmen. Aber nicht bei allen Tests
fallen die Ergebnisse bei höheren Konzentrationen wieder ab, bei
manchen Tests bleiben die Ergebnisse wenigstens hoch, in einer Art Sättigung.
Hat man dann ein hohes Resultat, weiß man, dass es noch viel höher
sein könnte und muss die Probe nach Verdünnung der Probe
noch einmal messen. Man wird aber nie eine hohe
Konzentration
als falsch niedrig ausgeben. Die nachfolgende Abbildung zeigt einen
solchen Test, der keinen High-Dose-Hook-Effekt aufweist.
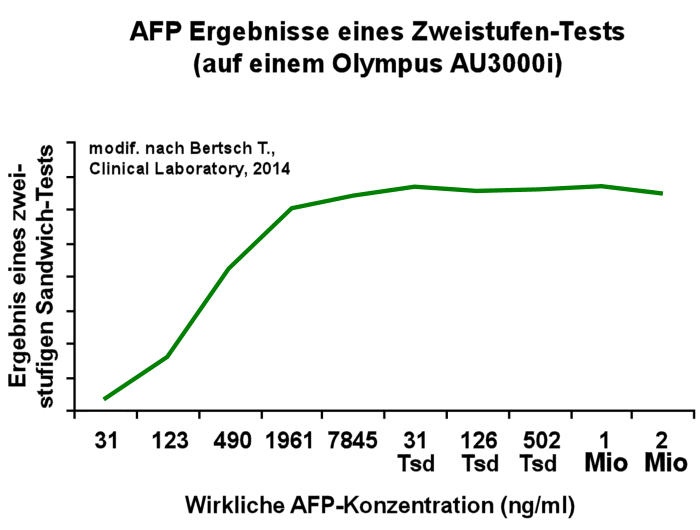
Diese Lösung ist aber in der Praxis auch
nicht so einfach. Hat man das Gerät eines bestimmten Herstellers im
Labor, dann muss man auch dessen Tests verwenden. Und da gibt es
vielleicht keinen Test, der keinen High-Dose-Hook-Effekt hat.
Als
Hintergrund: bei den Immunoassays sind es die Zweistufen-Tests, die
den High-Dose-Hook-Effekt praktisch nicht haben. Zweistufen heißt,
dass nach der Zugabe des "Fixierungs"-Antikörpers erst einmal
gewaschen wird und erst danach der "Detektions"-Antikörper
hinzugefügt wird. Umgesetzt auf das oben dargestellte Beispiel des
Magnet-Sandwich-Tests: man müsste zuerst den Magnet-Antikörper
dazu geben, dann das Magnetfeld anlegen, dann kann man den
überschüssigen Analyt wegwaschen, dann gibt man den
Markierungs-Antikörper dazu. Dann gibt es keinen
High-Dose-Hook-Effekt mehr, es können keine falsch niedrigen
Resultate mehr entstehen: Bei Analyt-Überschuss werden alle mit dem
Magnet-Antikörper fixierten Analytmoleküle auch mit dem
Markierungsantikörper markiert. Bei noch größerem
Analyt-Überschuss wird zwar das gleiche Resultat herauskommen
(Sättigung), es kommt aber zu keinem paradoxen Abfall der Ergebnisse (siehe obige Abbildung).
Warum man dann
überhaupt Einstufentests? Weil es einfachere und schnellere
Testverfahren sind.
|





