|
Wo
liegt das Problem? In der Einführung zur Durchflusszytometrie war doch
alles ganz einfach beschrieben: Man markiert die Lymphozyten mit einem grünen
Fluoreszenzfarbstoff (z.B. CD8-FITC) und mit einem roten (z.B. CD4-PE). Dann lässt man
die Probe durch das Durchflusszytometer laufen. Die Grünfluoreszenz der Zellen misst das
Zytometer im FL1-Kanal (FITC-Kanal, 525 nm Wellenlänge), die Rotfluoreszenz im
FL2-Kanal (PE-Kanal, 575 nm).
Man erhält so eine ideale Trennung: Die mit FITC markierten Zellen
sind nur im FITC-Kanal positiv, die mit PE markierten nur im PE-Kanal:
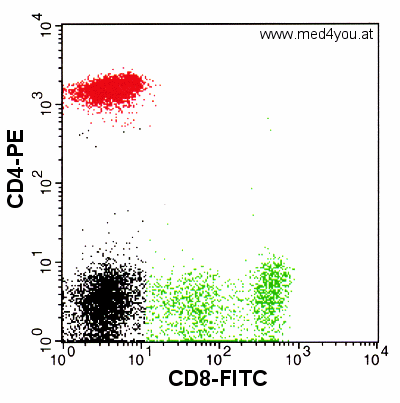 |
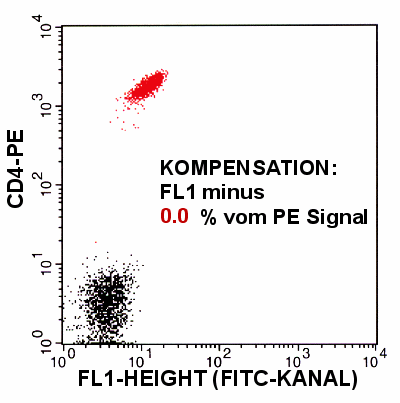
Ergebnis einer Färbung mit CD8-FITC und CD4-PE bei
korrekter Kompensation
Die in der Darstellung grün eingefärbten Zellen sind CD4 komplett negativ, die
rot-eingefärbten sind CD8-komplett negativ. So wie man sich das auch wünschen würde,
weil eine CD8-T-Zelle kein CD4 exprimiert und eine CD4-positive T-Zelle kein CD8.
Anmerkung: die grüne bzw. rote Einfärbung der Zellen ist willkürlich. Sie dient
nur der Hervorhebung der Populationen. |
Das funktioniert aber nur, weil die Messwerte der Zellen
rechnerisch korrigiert, man sagt "kompensiert" wurden. Ohne
diese rechnerische Kompensation sähe der Plot ganz anders aus:
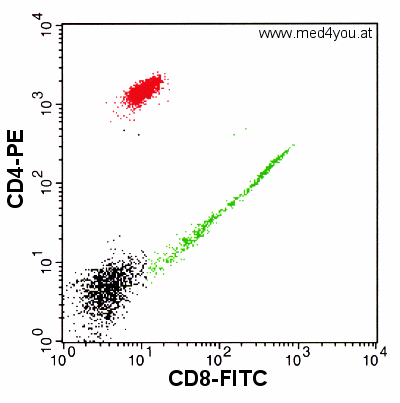 |
Ergebnis einer Färbung mit CD8-FITC und CD4-PE OHNE
Kompensation
So sieht das ohne Kompensation aus. So sehen die echten Messwerte aus, die das
Durchflusszytometer misst. Es gibt praktisch nur doppelt positive Zellen: Alle Zellen sind
in beiden Kanälen stärker fluoreszierend als die negativen Zellen (schwarz).
|
Dieser Plot schaut weniger schön aus. Unsere CD8-positiven
Zellen (in grün) scheinen alle auch CD4-positiv. Und unsere CD4-positiven (in rot)
scheinen auch CD8-positiv zu sein.
Das entspricht aber nicht der Biologie der Zellen, denn die CD8-positiven sollten nicht
CD4-positiv sein und die CD4-positiven nicht CD8-positiv (zumindest im Blut). Die
unkompensierte Darstellung führt also zu eigenartigen Ergebnissen.
Um die Sache zu vereinfachen, färben wir einmal nur mit CD8-FITC,
dann sollten doch keine doppelt-positiven Zellen auftreten, denn wir gaben ja gar keinen
"roten" Antikörper dazu:
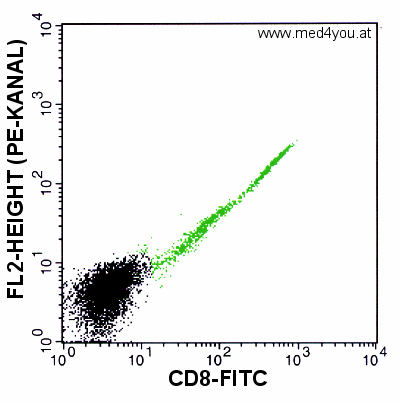 |
Ergebnis einer Färbung nur mit CD8-FITC OHNE
Kompensation
Obwohl wir gar keinen "roten" Antikörper dazugeben, erscheinen die
CD8-positiven Zellen auch im Kanal FL2 (dem "roten" Kanal) positiv.
|
Dieser Plot sieht auch nicht besser aus. Alle CD8-positiven
Zellen sind auch im zweiten Kanal positiv. Warum ist das so? Vor dem Detektor des zweiten
Kanals (FL2) ist doch ein Farbfilter, das Grün gar nicht durchlässt.
Ursache: FITC leuchtet nicht nur grün
In unserer idealisierten Vorstellung leuchtet eine FITC-positive Zelle nur grün. Weil
FITC ein grüner Fluoreszenzfarbstoff ist. Leider ist das nicht so. FITC leuchtet nicht
nur grün. Es leuchtet zwar grün am stärksten aber es leuchtet auch auf vielen anderen
Wellenlängen.
Die Wellenlängen die FITC ausstrahlt, kann man am besten mit einem Wellenlängen- oder
Frequenzspektrum darstellen. Da es um die Ausstrahlung geht, nennt man das Emissionsspektrum.
Das sieht bei FITC so aus:
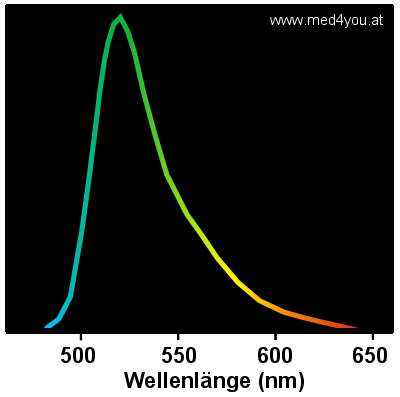 |
Emissionsspektrum von FITC
FITC strahlt nicht nur grün (Gipfel), es strahlt auch bei größeren
Wellenlängen. FITC strahlt auch gelb und rot, wenn auch viel schwächer. |
Aus dem Spektrum wird erkennbar: FITC strahlt auch in anderen
Farben. Eine FITC-positive Zelle wird daher auch in anderen Kanälen des
Durchflusszytometers einen, wenn auch kleineren Impuls auslösen.
Sie mögen jetzt sagen, dass dieser minimale Rotanteil doch nicht so ein starkes Signal in
FL2 gemacht haben kann. Die FITC-positiven Zellen lagen doch fast schon in der Mitte der
FL2-Achse, etwa bei 300.
Um das zu verstehen muss man sich von einem Vorurteil befreien: PE fluoresziert nicht rot
sondern gelb und der FL2/PE-Kanal misst daher nicht rotes Fluoreszenzlicht sondern gelbes.
Und der Gelbanteil von FITC ist beträchtlich, wie das obige Spektrum zeigt.
Hintergrundinfo: Die falsche Vorstellung vom "roten" PE ist
wahrscheinlich aus der Entwicklung der Durchflusszytometrie erklärbar. Anfangs hatten
Durchflusszytometer nur einen Fluoreszenzkanal, meist für FITC, den grünen Farbstoff.
Dann kam ein zweiter Farbstoff dazu - das PE. Da sich rot-grüne Darstellungen viel
hübscher machen als rot-gelbe wurde das PE oft mit der Farbe rot symbolisiert. Auch die
Antikörperhersteller füllten ihre FITC-Antikörper in grüne, die PE-Antikörper in rote
Fläschchen. So entstand das falsche Bild vom roten PE.
Jetzt wird klar, warum die FITC-gefärbten Zellen im
Durchflusszytometer so aussehen:
 |
Der beträchtliche Gelbanteil der FITC-Fluoreszenz wird im PE-Kanal
mitgemessen. Deswegen sind die CD8-positiven Zellen so weit oben.
|
Ist das überhaupt ein Problem?
Ja, sicher. So kommen z.B. bei bestimmten Lymphomen sehr wohl CD4/CD8-doppelt positive
Lymphozyten vor. Dies ist sogar eine große Hilfe bei der Diagnose dieser Krankheiten. Um
dies zu erkennen, könnte man die Lymphozyten gleichzeitig mit CD8-FITC und CD4-PE
färben. Wenn aber die CD8-Zellen ohnehin schon stark positiv im PE-Kanal sind, weil das
CD8-FITC in den PE-Kanal hineinstrahlt, dann ist nur mehr sehr schwer zu erkennen, ob auch
das CD4-PE auf den CD8-positiven Zellen sitzt.
|
|
|
Wie löst
man das Problem?
Man löst das Problem mit einer rechnerischen Korrektur: Wenn ich weiß, dass FITC auch in
den PE-Kanal strahlt, dann weiß ich, dass ich vom PE-Signal, das ich messe, etwas
abziehen muss. Nämlich genau den Anteil der vom FITC stammt.
Dazu gibt es in der Software der Durchflusszytometer meist eine spezielles Menü. Dort
finden Sie eine Angabe, die vielleicht lautet:
FL2 = FL2 - X% FL1 |
sinngemäß könnte es auch heißen: |
FL2wahr =
FL2gemessen - X% FL1gemessen |
D.h., das FL2 Signal wird folgendermaßen berechnet:
vom gemessenen Wert im Kanal FL2 wird ein bestimmter Anteil des Signals in FL1 (dem
FITC-Signal) abgezogen. In anderen Worten: der Anteil der des FL2-Signals, der vom FITC
kommt, wird vom FL2-Signal abgezogen. Dadurch erhält man den wahren Wert der
FL2/PE-Expression der Zellen.
Diesen Vorgang nennt man die Kompensation.
Wie hoch der Prozentsatz ist, den man abziehen muss, wird entweder
in einer automatische Kompensationsroutine vom Gerät ermittelt, oder man macht es selbst,
was sehr informativ ist.
Wie stellt man die Kompensation ein?
Nachfolgend ein Beispiel zum Einstellen der Kompensation von FL1
gegen FL2.
Die Lymphozyten wurden mit CD8-FITC gefärbt:
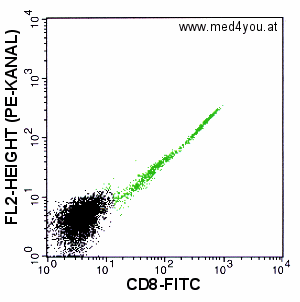 |
Kompensation: FL2 = FL2 - 0% FL1
Noch einmal zur Erinnerung die unkompensierte Messung. Es ist klar, dass es so nicht
bleiben darf. Wir müssen einen Teil des FL1-Signals von FL2 abziehen. |
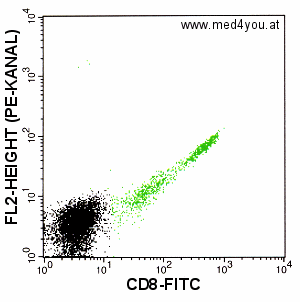 |
Kompensation: FL2 = FL2 - 23% FL1
Noch immer viel zu wenig kompensiert: Obwohl wir schon 23% des FITC-Signals von FL2
abziehen, liegen die Zellen immer noch im "FL2-positiven" Bereich. Stark
unterkompensiert. |
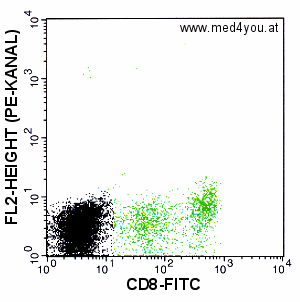 |
Kompensation: FL2 = FL2 - 40% FL1
Sieht schon besser aus, aber es reicht noch nicht ganz. Der Haufen stark CD-8-positiver
Zellen liegt noch immer höher als der Haufen der negativen (schwarzen) Zellen. Er sollte
aber auf gleicher Höhe liegen. Also immer noch unterkompensiert. |
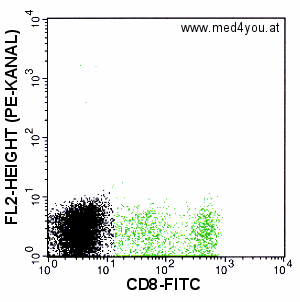 |
Kompensation: FL2 = FL2 - 45% FL1
Sieht ganz gut aus. Damit könnte man arbeiten.
Es gibt viel mehr schwarze als grüne Zellen, sodass die visuelle Beurteilung nicht
leicht ist, das Maximum der Zellen scheint etwa in gleicher Höhe. Vielleicht schon ein
wenig überkompensiert. Man könnte es mit ein, zwei % weniger versuchen und sich den
Median ausrechnen lassen (siehe weiter unten).
|
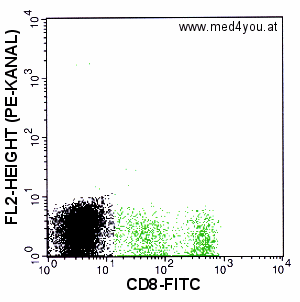 |
Kompensation: FL2 = FL2 - 49% FL1
Eindeutig zu stark kompensiert. Der Haufen stark CD-8-positiver Zellen liegt tiefer als
der Haufen der negativen Zellen: überkompensiert. |
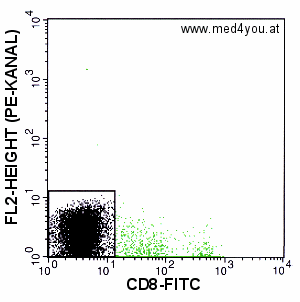 |
Kompensation: FL2 = FL2 - 55% FL1
Viel zu stark kompensiert. Der Haufen stark CD-8-positiver Zellen ganz gegen die Achse
gedrückt: stark überkompensiert. |
So geht man praktisch vor
So ähnlich wie in den Abbildungen gezeigt kann man die Kompensation tatsächlich
einstellen. Man braucht zur Einstellung der Kompensation eine Probe mit zwei
Zellpopulationen: eine Population ungefärbter Zellen und eine gefärbter Zellen.
Ansonsten sollten die Zellen der beiden Populationen einander möglichst ähnlich sein.
Meist wählt man Lymphozyten (indem man diese im Scattergate auswählt). Damit ein Teil
der Lymphozyten gefärbt wird, ein anderer aber ungefärbt bleibt, kann man passende
Marker nehmen. Z.B. CD4, das färbt nur einen Teil der Lymphozyten. Noch korrekter ist es,
wenn man erst einmal 2 Proben vorbereitet. Bei der einen färbt man die Lymphozyten, mit
z.B. CD45, bei der zweiten Probe färbt man nicht. Vor der Messung gießt man die 2 Proben
zusammen. Man hat jetzt in der Probe eine CD45-positive, gefärbte und eine CD45-negative,
ungefärbte Population. Die zwei Populationen sind ansonsten völlig ident.
Monozyten und Granulozyten sind aufgrund der höheren Autofluoreszenz nicht so gut
zum Einstellen der Kompensation geeignet.
Muss man die Kompensation so genau einstellen?
Das wäre schon ideal. Bei der Beurteilung stark positiver und deutlich abgesetzter
Population ist das Problem nicht so groß. Aber eine Beurteilung schwacher
Antigenexpressionen ist bei falscher Einstellung schwierig. Auch bei kontinuierlicher
Antigenexpression ("schmierende" Expression) könnten falsche Resultate
entstehen.
|
|
|
Auch
PE strahlt in andere Kanäle Es ist
nicht so, dass nur die FITC-Fluoreszenz in andere Kanäle streut. Auch das PE strahlt
nicht nur gelb, es strahlt auf verschiedenen Wellenlängen, wie sein Emissionsspektrum
deutlich macht:
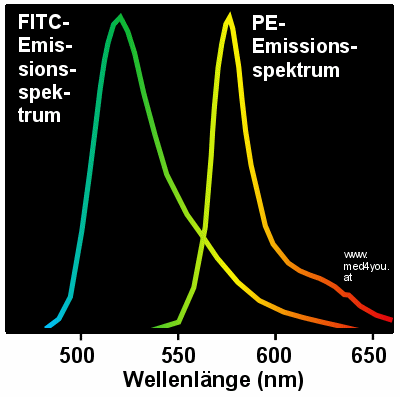 |
Emissionsspektrum von FITC und PE
PE strahlt nicht nur gelb (Gipfel), es strahlt auch bei kürzeren Wellenlängen.
Es strahlt auch ein wenig grün. Daher wird ein PE-Signal auch im FL1/FITC-Kanal
detektiert. |
Daher sieht auch eine mit CD4-PE gefärbte Probe ohne Kompensation
nicht optimal aus:
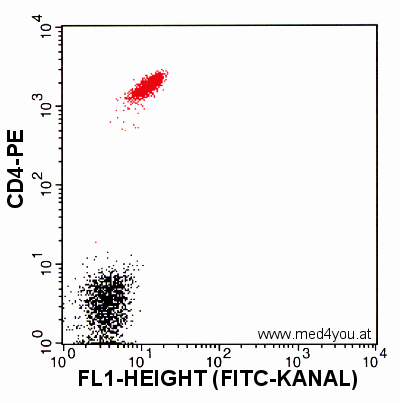 |
CD4-PE ohne Kompensation
Der Grünanteil der PE-Fluoreszenz wird im FITC-Kanal mitgemessen. Deswegen sind die
CD4-positiven Zellen so weit rechts.
|
Versuchen
sie selbst die richtige Kompensation zu finden
FL1 = FL1 - X % FL2 |
 |
Klicken Sie auf die blauen Felder um
verschieden starke Kompensationen auszuprobieren |
Wie sie sehen, muss man von PE auf FITC nicht allzuviel
kompensieren. Das liegt vor allem daran, dass PE nur einen sehr geringen Grünanteil hat
(siehe PE-Emissionsspektrum weiter oben). Dennoch muss man ein wenig kompensieren. Von den
obigen Möglichkeiten erscheint eine Kompensation von 0.5% das beste Ergebnis zu bringen.
0.3% ist noch unterkompensiert und 0.7% bereits überkompensiert. Bei 0.5% liegt die
Population der CD4-positiven Lymphozyten ziemlich genau über der der CD4-negativen Zellen
(schwarz dargestellt).
Kann Überkompensation ein Problem sein?
Ja, oft ein größeres als die Unterkompensation. Wenn Sie unterkompensieren, kann es
passieren, dass sie eine Population fälschlicherweise für positiv halten. Wenn Sie stark
überkompensieren, kann es sein, dass Sie eine schwächer positive Population für negativ
halten oder bei starker Überkompensation die ganze Population übersehen, weil sie gegen
die Achse gedrückt ist (siehe obiges Beispiel, Button 5).
Technische
Anmerkungen
- Manchmal würde man sich beim Einstellen der Kompensation eine
zusätzliche Kommastelle wünschen, weil der ideale Wert z.B. zwischen 0.4% und 0.5%, also
vielleicht bei 0.45% liegt. Nicht bei allen Durchflusszytometern ist das möglich. Meist
ist dies aber auch nicht so wichtig, da die Kompensation sowieso von Antikörper zu
Antikörper ein wenig schwankt und daher eine zu genaue Einstellung mit einem bestimmten
Antikörper wenig bringt.
- Außer der optischen Beurteilung legt man sich natürlich noch
eine Region über die positive und negative Population und lässt sich die mediane
Fluoreszenzintensität oder das geometrische Mittel der Fluoreszenzintensität anzeigen.
Diese Werte sollten bei beiden Populationen etwa gleich sein.
|
|
|
Für Fortgeschrittene Die Kenntnis der nachfolgenden Punkte ist zum Einstellen einer korrekten
Kompensation nicht notwendig, vielleicht sind die Fragen aber für Sie von Interesse.
Warum eine
hohe Kompensation nicht gut ist
Nach dem Lesen des Obenstehenden könnte man meinen, es macht gar
nichts, wenn sich zwei Fluoreszenzfarbstoffe, die man verwendet, weit überlappen. Man
kann das ganze ja rechnerisch kompensieren. Prinzipiell ja, es ist aber dennoch nicht zu
empfehlen mit sehr hohen Kompensationsfaktoren zu arbeiten. Nicht nur deswegen, weil dann
eine leichte Fehlkompensation große Folgen hätte, auch bei optimal eingestellter
Kompensation ergeben sich Nachteile:
Messfehler übertragen sich in den anderen Kanal
Stellen wir uns zuerst den idealen Fall vor: eine Probe wird mit z.B. CD45-FITC gefärbt.
Sie haben ermittelt, dass die Kompensation zwischen FITC und PE 40% sein muss. Eine Zelle
hat ein gemessenes FITC-Signal von 100 und ein gemessenes PE Signal von 40. Sie wissen ja,
dass sie jetzt von dem PE-Signal 40% des FITC-Signals abziehen müssen. 40% von 100 sind
40. Das errechnete PE Signal ist das gemessene minus dem FITC Anteil also 40 minus 40.
Ergibt 0. Ideal.
In Wirklichkeit ist eine Messung nie fehlerlos, und so kann es sein, dass das FITC-Signal
fälschlicherweise mit 90 gemessen wurde. Der PE-Kanal hat richtig gemessen, also 40. 40%
von 90 sind aber nur 36. Wenn sie jetzt vom PE-Signal 40% des FITC-Signals, also 36,
abziehen bleibt immer noch 4 über. Die Zelle scheint also ein PE-Signal zu haben. Aber
nur, weil die Messung im FITC-Kanal nicht korrekt war.
Wird auf der anderen Seite im FITC-Kanal fälschlicherweise zu viel gemessen, wird das
PE-Signal fälschlicherweise zu stark kompensiert (in unserem Fall würden dann Minuswerte
resultieren, was nicht möglich ist. Wenn aber die Zelle eine echte PE-Expression hätte,
würde diese durch die Kompensation dann dann zu stark nach unten korrigiert).
Die Präzision im Nachbarkanal sinkt
In der Summe führt der Effekt zu einer größeren Streuung der PE-Werte.
Wenn der Fehler im FITC-Kanal ein zufälliger Fehler ist, was anzunehmen ist. Einen
systematischen hätte man ja bei der Kompensationseinstellung berücksichtigen müssen
oder er hätte bei der Analyse auffallen müssen.
| Lymphozytenpopulation links ohne
Antikörper, recht gefärbt mit CD45-FITC: |
 |
 |
Sehen die den Unterschied in der "PE-Expression" der
beiden Populationen? Vielleicht in der Vergrößerung:
| Lymphozytenpopulation links ohne
Antikörper, recht gefärbt mit CD45-FITC: |
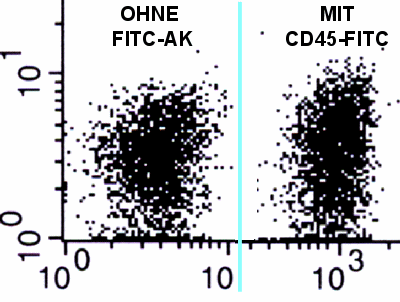 |
Auf der rechten Seite streut die Population in der
PE-Expression etwas mehr. Sowohl nach unten als auch nach oben. Dies entsteht durch die
Übertragung des Messfehlers aus dem FITC-Kanal in den PE-Kanal. Und der überträgt sich,
wie oben beschrieben, durch die Kompensation.
|
Zugegeben, der Effekt ist nicht besonders groß, weil die
Messfehler moderner Geräte meist nicht sehr hoch sind. Aber je höher die Kompensation
und je stärker der Messfehler, desto größer ist dieser Effekt.
Ein häufiger
Fehler
Wie im vorigen Absatz erklärt, darf die positive Zellpopulation
etwas mehr streuen, also eine höhere Verteilungsbreite aufweisen als die negative. Ja das
muss eigentlich so sein. D.h. aber, dass auch bei korrekter Einstellung der Kompensation,
ein paar Zellen der positiven Population über die Schwelle fallen, die man nach der
Negativkontrolle gesetzt hat. Das ist in Ordnung so. Falsch wäre es, die Kompensation so
lange zu erhöhen, bis keine Zelle mehr über dieser Schwelle liegt. Ein Beispiel macht
dies vielleicht klarer:
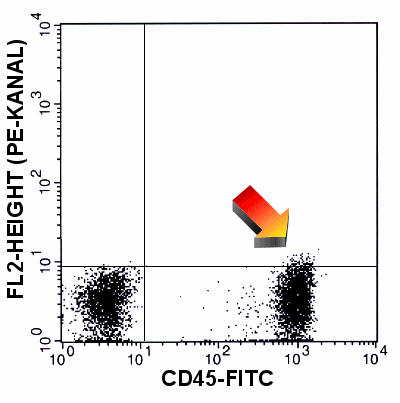 |
Analyse eines Gemisches CD45-FITC-gefärbter
Lymphozyten und ungefärbter Lymphozyten.
Die Kompensation ist recht gut eingestellt, die beiden Haufen liegen etwa in
gleicher Höhe. Weil die CD45-positiven Zellen aber mehr streuen, liegen ein paar über
der Schwelle (Pfeil). Das darf einen aber nicht stören. Das stimmt so. |
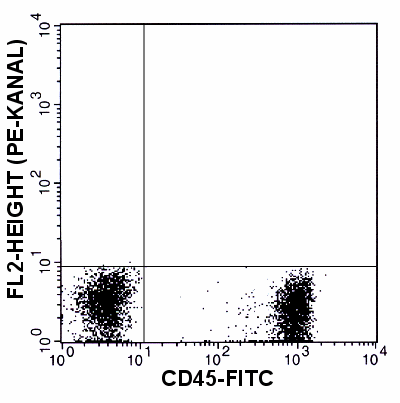 |
Analyse eines Gemisches CD45-FITC-gefärbter
Lymphozyten und ungefärbter Lymphozyten.
Die Kompensation wurde jetzt höher eingestellt, damit keine Zellen mehr über
der Schwelle liegen. Diese Probe ist aber deutlich überkompensiert: der
Haufen der CD45-positiven Zellen liegt tiefer als der der negativen Zellen. |
Warum man
bei Veränderungen der PMT-Spannung die Kompensation ändern muss?
Sie haben die Kompensation FITC-PE korrekt eingestellt. Dann ändern
Sie die PMT-Spannung ihrer FITC-PMT und plötzlich stimmt die Kompensation gar nicht mehr.
Auf den ersten Blick könnte man sich fragen, warum? Der Gelbanteil von FITC ist doch
immer gleich, egal wie hoch man die PMT-Spannung einstellt.
Ja, der Anteil ist immer gleich. Aber der Messwert, den Sie erhalten, ändert sich nach
Veränderung der PMT-Spannung. Und wenn Sie nur die FITC oder nur die PE-PMT-Spannung
ändern, dann ändert sich auch der Wert, mit dem Sie kompensieren müssen.
Beispiel:
Sie hatten eine optimale Kompensation bei 20%. D.h., wenn sie bei einer nur
FITC-gefärbten Probe ein FITC-Signal von 200 gemessen haben, haben Sie im PE-Kanal 40
gemessen. Sie haben 20% von 200 also 40 vom PE-Signal abgezogen, das ergab 0 und alles war
in Ordnung.
Wenn Sie jetzt die FITC-PMT-Spannung vermindern, messen Sie im FITC-Kanal vielleicht nur
mehr 160. Aber nicht, weil die Zelle schwächer fluoresziert, sondern nur, weil Sie den
FITC-Kanal PMT-Verstärker schwächer eingestellt haben. Den PMT-Verstärker des PE-Kanals
haben Sie aber nicht verändert, daher werden Sie im PE-Kanal weiter ein Signal von 40
messen. Eine 20%-Kompensation reicht jetzt nicht mehr aus. 20% von 160 sind 32, wenn Sie
32 von dem PE-Kanal-Signal von 40 abziehen bleiben immer noch 8 übrig. Die Probe ist
unterkompensiert.
Vermindern Sie PMT-Spannungen, muss man die Kompensation gegen die Nachbarkanäle
erhöhen, erhöhen Sie die Spannung, muss man sie vermindern. |
|




