|
Woher
kommt der Name? Der Name
Durchflusszytometrie kommt daher, dass bei dieser Technik verschiedene Eigenschaften von
Zellen oder anderen Teilchen untersucht werden, während diese Zellen hintereinander (im
"Gänsemarsch") durch eine dünne Messkammer fließen. Im Englischen heißt die
Technik "Flow Cytometry" und die Messkammer "Flow Cell", also
Flusszelle. Für die meisten Anwendungen der Durchflusszytometrie ist diese Flusszelle aus
Glas und die zu untersuchenden Zellen werden beim Durchfließen von der Seite von einem
Laserlicht angestrahlt.
 |
Durchflusszellenblock eines Durchflusszytometers
Die Zellen kommen von oben (grauer Pfeil) und fließen hintereinander durch die
eigentliche Flusszelle (die Strecke innerhalb der Flusszelle ist durch einen grauen Strich
gekennzeichnet). Dabei werden die Zellen von einem Laser von der Seite bestrahlt (blau
eingezeichnet).
Der dargestellte Block ist etwa 4 cm x 7 cm groß. |
Die Geräte, mit denen man durchflusszytometrische Analysen
durchführt, heißen Durchflusszytometer, auch "FACS-Geräte" oder kurz
"FACS" genannt, die Analysen "FACS-Analysen".
Der Ausdruck "FACS" ist ein registriertes Markenzeichen der Firma
Becton-Dickinson und steht eigentlich für Fluorescence Activated Cell Sorting. Er hat
sich aber inzwischen als Ausdruck für Durchflusszytometrie eingebürgert, wie
"Tixo" für Klebeband.
 |
Durchflusszytometer der Firma Beckman-Coulter mit
Computer zur Datenauswertung
(Foto Firma Beckman-Coulter) |
|
|
|
1.
Das Streulicht (engl. Light Scatter) Eine
Eigenschaft einer Zelle, die in der Durchflusszytometrie gemessen wird, ist das
Streulicht.
Eine den Laserstrahl kreuzende Zelle verursacht Streulicht. Je größer eine Zelle ist und
je mehr Strukturen in ihrem Inneren sind, desto größer ist das entstehende Streulicht.
Somit erhält man durch Messung des Streulichts auf einfache Weise wichtige Informationen
über die Zelle.
Die Zelle streut das Licht in verschiedene Richtungen. Je nachdem in
welchem Winkel man das Streulicht misst, erhält man unterschiedliche Informationen.
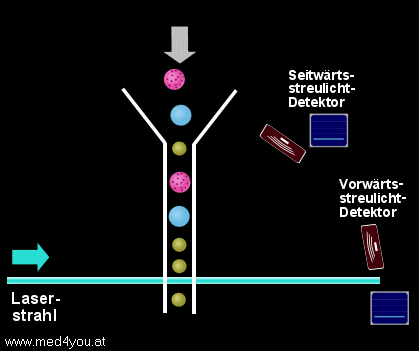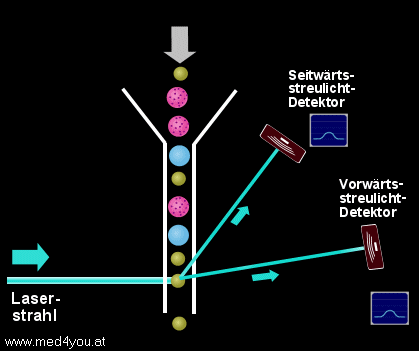 |
Streulichtmessung
Solange der Laserstrahl ungehindert durch die Flusszelle geht, entsteht kein Streulicht.
Quert hingegen eine Zelle den Strahl, wird das Licht in verschiedenste Richtungen
gestreut.
Gemessen wird das Streulicht meist an 2 Stellen:
a) (fast) in Richtung des ursprünglichen Strahls (Vorwärtsstreulicht)
und
b) etwa im 90° Winkel zum ursprünglichen Strahl (Seitwärtsstreulicht)
|
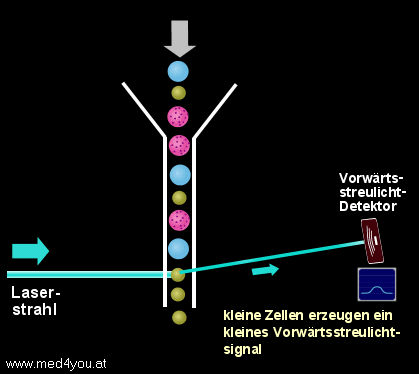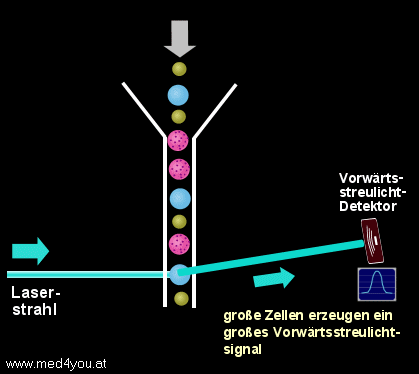
a) Das Vorwärtsstreulicht
(engl. Forward Light Scatter oder Low Angle Scatter)
Das Vorwärtsstreulicht hängt vor allem von der Größe einer Zelle ab. Das heißt,
kleine Zellen verursachen ein kleines Vorwärtsstreulichtsignal, große Zellen ein
großes.
 |
Vorwärtsstreulicht
(Forward-Scatter)
Das (fast) in Vorwärtsrichtung des Laserstrahl gestreute Licht gibt Auskunft über
die Größe der Zelle.
|
b) Das Seitwärtsstreulicht
(engl. Side Scatter, Orthogonal Scatter oder Right Angle Scatter)
Das Seitwärtsstreulicht hängt neben der Größe auch sehr stark vom Inhalt einer Zelle
ab. Finden sich in der Zelle sehr viele Lysosomen (das sind kleine, Enzym-speichernde
Bläschen), dann hat sie ein großes Seitwärtsstreulicht, finden sich nur wenige, dann
ist ihr Seitwärtsstreulicht gering.
Im Lichtmikroskop, nach Anfärbung der weißen Blutkörperchen, werden die Lysosomen als
körnige Strukturen sichtbar. Daher kann man auch sagen: ist eine Zelle im Lichtmikroskop
körnig aussehend, dann wird sie in der Durchflusszytometrie im allgemeinen ein hohes
Seitwärtsstreulicht erzeugen. Sieht sie nicht körnig aus, hat sie ein niedrigeres
Seitwärtsstreulicht.
| Weiße Blutkörperchen |
 |
 |
 |
Lymphozyt
klein, kaum Granula |
Monozyt
groß, kaum Granula |
Neutrophiler
Granulozyt
groß, Granula |
In der Fachsprache nennt man diese Körner in der Zelle Granula und die Körnigkeit einer
Zelle Granularität.
Man spricht dann also davon, dass das Seitwärtsstreulicht von der Granularität der Zelle
abhängt. Hohe Granularität ("viele Körner in der Zelle") hohes
Seitwärtsstreulicht, niedrige Granularität ("wenige oder gar keine Körner in der
Zelle") niedriges Seitwärtsstreulicht.
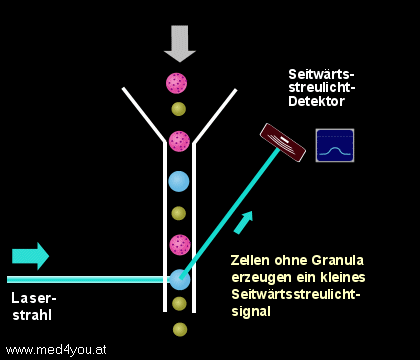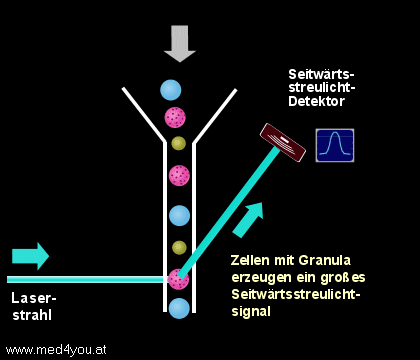 |
Seitwärtsstreulicht
(Side Scatter, Right Angle Scatter)
Das etwa im rechten Winkel zum Laserstrahl entstehende Streulicht hängt sowohl von der
Größe der Zellen, aber auch sehr stark von der Granularität (der
"Körnigkeit") der Zellen ab. |
Um die Streulicht-Messergebnisse anschaulich darzustellen, werden
die Zellen in einer Graphik, einem sog. Dot-Plot, dargestellt. Dabei wird meist auf der
x-Achse das Vorwärts- und auf der y-Achse das Seitwärtsstreulicht aufgetragen.
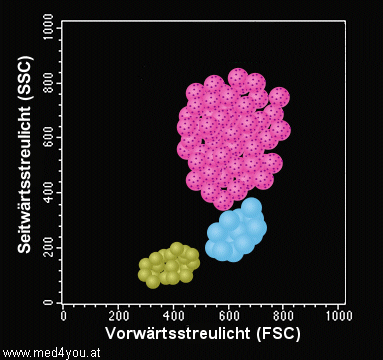 |
Streulicht-Dot-Plot
(schematische Darstellung)
Die Zellen werden nach ihrem Vorwärtsstreulicht und ihrem Seitwärtsstreulicht im
Diagramm dargestellt (Dot-Plot).
Man erkennt Anhäufungen von Zellen, die offenbar ähnliche Streulichteigenschaften
haben. Die grüne Ansammlung entspricht den Lymphozyten (klein, kaum Granula), die blaue
den Monozyten (groß, kaum Granula), die rosa-farbene den Neutrophilen Granulozyten
(groß, viel Granula). |
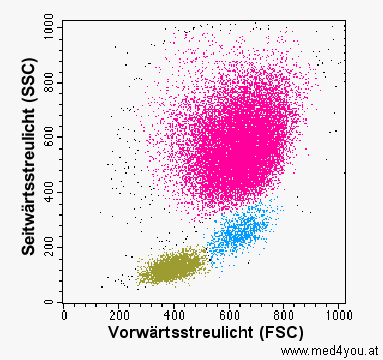
|
Streulicht-Dot-Plot
(reale Darstellung)
So sieht ein Dot-Plot in Wirklichkeit aus. Jeder Punkt entspricht einer gemessenen Zelle
(bzw. allgemein gesagt, einem gemessenen Ereignis, denn es müssen nicht immer Zellen
sein, die man misst).
Die Farben kann man den einzelnen Zellen bei der Auswertung zuordnen. Sie haben
nichts mit der Farbe oder Fluoreszenz der Zellen zu tun. |
Anmerkung: der
Übersichtlichkeit halber wurde auf die Basophilen und Eosinophilen Granulozyten nicht
näher eingegangen. |
|
|
|
2.
Das Fluoreszenzsignal
Das Durchflusszytometer kann mehr
Im vorigen Abschnitt wurde dargestellt, wie man durch Auswertung des Streulichts die
wichtigsten Untergruppen der weißen Blutkörperchen (Granulozyten, Monozyten und
Lymphozyten) unterscheiden kann. Das wäre aber noch nichts Besonderes, das kann fast
jedes einfache Blutbild-Analysengerät. Ein modernes Durchflusszytometer kann aber mehr:
es kann auch Fluoreszenzlicht messen und erlaubt dadurch, eine Vielzahl von Merkmalen auf
den Blutzellen zu untersuchen.
Zellen müssen markiert werden
Will man eine bestimmtes Merkmal einer Zelle untersuchen, muss man dieses Merkmal zuerst
einmal markieren. Und das geschieht mit einem Antikörper, der gegen dieses Merkmal
gerichtet ist. Außerdem trägt dieser Antikörper eine fluoreszierende Gruppe. Das ist
ein Molekül, das aufleuchtet, wenn es mit einem Laser oder einer anderen Lichtquelle
bestrahlt wird. Solche Antikörper kann man bei verschiedenen Firmen kaufen. Und es gibt
sie bereits gegen eine große Zahl von Zellmerkmalen.
Bringt man Antikörper und Zellen zusammen, setzt sich der Antikörper auf diejenigen
Zellen, die das Merkmal auf der Oberfläche tragen. Die Zelle ist dadurch markiert und
wird bei Durchqueren des Laserstrahls des Durchflusszytometers aufleuchten.
Darstellung der Fluoreszenzmessung anhand eines Beispiels:
die Bestimmung der T- und der B-Lymphozyten
Die Lymphozyten des Blutes sehen im Mikroskop zwar recht einheitlich aus, bestehen aber
aus verschiedenen Untergruppen. Die wichtigsten sind die T-Lymphozyten, B-Lymphozyten und
die Natural-Killer-Zellen. Diese Gruppen sind aber weder im Mikroskop noch mit einem
normalen Blutbild-Analysegerät eindeutig zu unterscheiden.
 |
Einem Lymphozyten sieht man auch im Mikroskop (meist) nicht
an, ob er ein B- oder T-Lymphozyt ist oder ob er eine Helper-Zelle, eine
Natural-Killer-Zelle oder eine zytotoxische Zelle ist. Die Durchflusszytometrie kann dies
abklären. |
Will man wissen, wieviel T-Zellen und B-Zellen im Blut eines Patienten sind, führt man
eine durchflusszytometrische Analyse durch.
Dazu braucht man einmal einen Antikörper, der uns die T-Lymphozyten markiert. Diese
tragen ein Merkmal an ihrer Oberfläche, das man CD3 nennt. Also brauchen wir einen
Antikörper gegen CD3. Damit wir im Durchflusszytometer auch etwas sehen, nehmen wir einen
CD3-Antikörper, an den ein Fluoreszenzmolekül gekoppelt ist. Nehmen wir z.B. einen
FITC-gekoppelten Antikörper. FITC (Fluoreszein-Isothiocyanat) ist ein
grünfluoreszierendes Molekül. Kurz gesagt, wir nehmen einen CD3-FITC Antikörper.

|
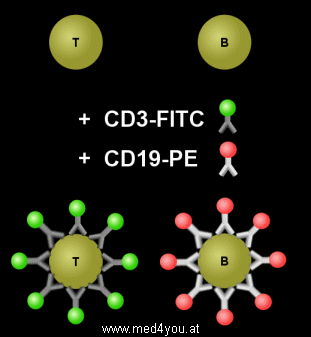
Antikörper gegen T- und B-Lymphozyten
Grün-fluoreszierender Antikörper gegen T-Lymphozyten (CD3-FITC) und
gelbrot-fluoreszierender Antikörper gegen B-Lymphozyten (CD19-PE). In den Fläschchen
sind je 2 ml Flüssigkeit, in der die Antikörper gelöst sind. |
Die B-Zellen müssen wir aber auch markieren. Diese haben ein anderes Merkmal an ihrer
Oberfläche. Das Merkmal nennt man CD19. Wir nehmen also einen Antikörper gegen CD19.
Diesmal aber keinen an FITC gekoppelten sondern einen, der an einen anderen Farbstoff
gekoppelt ist. Z.B. einen an PE gekoppelten. PE (=Phycoerythrin) ist ein gelbrot
fluoreszierendes Molekül. Wir verwenden also den Antikörper CD19-PE.
Jetzt müssen wir das Blut des Patienten mit den Antikörpern zusammenbringen. Dazu gibt
man eine sehr kleine Flüssigkeitsmenge (5 - 20 µl) aus beiden
Antikörperfläschchen in ein Plastikröhrchen. Danach wird eine bestimmte Menge Blut
(25 - 100 µl) dazugegeben. Das lässt man dann eine Zeit stehen
(Inkubation).

|
Inkubation der Zellen mit den Antikörpern
Aus beiden Antikörperfläschchen wurden je 10 µl Antikörper in das
Röhrchen pipettiert. Danach wurden 50 µl Blut des Patienten hinzugefügt. Nach dem
Vermischen lässt man das ganze 10 bis 30 Minuten bei Raumtemperatur am besten
lichtgeschützt stehen. Das nennt man auch Inkubation, vom lateinischen incubare: auf
etwas liegen, brüten. Die Zellen werden gewissermaßen mit dem Antikörper bebrütet. |
Während der Inkubation setzen sich die CD3-FITC Antikörper auf die T-Lymphozyten und die
CD19-PE Antikörper auf die B-Lymphozyten. Die T-Lymphozyten werden also mit einem grünem
Fluoreszenzfarbstoff, die B-Lymphozyten mit einem gelbroten Fluoreszenzfarbstoff markiert.
|
Markierung der T- und B-Lymphozyten
Während der Inkubation (Bebrütung) der Blutzellen mit den Antikörpern
setzen sich die CD3-FITC Antikörper auf die T-Lymphozyten und die CD19-PE Antikörper auf
die B-Lymphozyten. Dies ist links schematisch dargestellt.
In Wirklichkeit sind die Antikörper im Vergleich zu den Lymphozyten viel kleiner
und es setzen sich tausende Antikörper auf eine Zelle.
|
Bevor man die weißen Blutkörperchen im Durchflusszytometer messen kann, muss man noch
die roten Blutkörperchen entfernen. Zu diesem Zweck gibt man ein spezielle Flüssigkeit
dazu, die die roten Blutkörperchen zerstört.

|
Lyse (Zerstörung) der roten Blutkörperchen
Im Blut sind etwa 1000 mal mehr rote als weiße Blutkörperchen. Es
erleichtert daher die durchflusszytometrische Messung der weißen Blutkörperchen, wenn
man die roten Blutkörperchen vorher entfernt. Dazu gibt man ein spezielles Mittel, ein
sog. Lyse-Reagenz dazu. Die Lyse der roten Blutkörperchen dauert etwa 10 Minuten. |
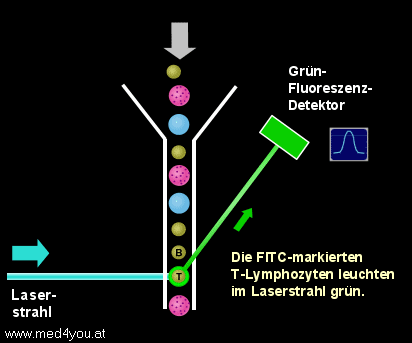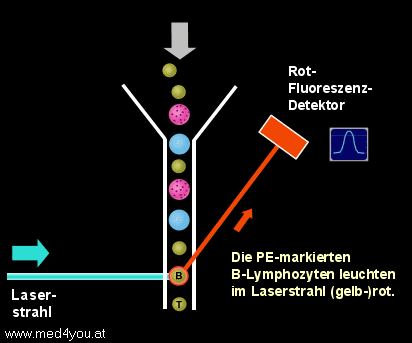
Nach der Lyse der roten Blutkörperchen kann man die weißen Blutkörperchen der Probe
ungestört am Durchflusszytometer messen. Die Probe wird in das Gerät gesaugt (genau
genommen wird sie mit Hilfe von Druck ins Gerät gedrückt, man spricht aber trotzdem
meist vom Ansaugen) und die Zellen fließen durch die Flusszelle des Geräts. Beim Queren
des Laserstrahls werden die T-Lymphozyten grün und die B-Lymphozyten gelb-rot
aufleuchten.
|
Messung der T- und B-Lymphozyten
Quert eine Zelle den Laserstrahl, die mit dem FITC-Antikörper markiert
ist, leuchtet sie grün auf.
Da wir CD3-FITC verwendet haben, können wir schließen, dass dies ein T-Lymphozyt
sein wird.
Eine (gelb)rot aufleuchtende Zelle wird ein B-Lymphozyt sein, da wir CD19-PE
verwendet haben und PE gelbrot fluoresziert.
|
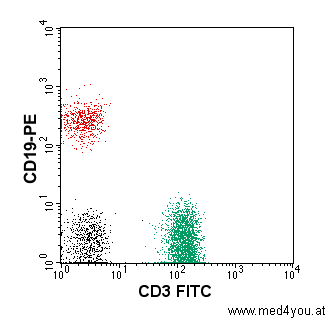
Wie bei den Streulichtsignalen stellt man auch die Ergebnisse der Fluoreszenzmessungen in
einer anschaulichen Graphik, einem Dot-Plot dar.
|
Dot-Plot Graphik der Ergebnisse der
Fluoreszenzmessung
Jeder Punkt entspricht einer Zelle.
Die FITC-Fluoreszenz (grün) ist auf der X-Achse, die PE-Fluoreszenz
(gelbrot) auf der Y-Achse aufgetragen.
Grün aufleuchtende Zellen sind daher rechts unten zu finden. Sie sind mit dem
T-Lymphozytenmarker CD3-FITC markiert, also die T-Lymphozyten.
Gelbrot aufleuchtende Zellen sind links oben. Sie sind mit dem B-Lymphozytenmarker
CD19-PE markiert, also B-Lymphozyten.
Die Punkte sind nur der Anschaulichkeit wegen grün oder rot
gefärbt. Das hat direkt nichts mit der Fluoreszenzfarbe zu tun. |
In der obigen Abbildung sieht man, dass im Blut des Patienten mehr T-Lymphozyten (grün)
als B-Lymphozyten (rot) waren. Das ist durchaus normal. Das obige Bild entspricht den
normalen Verhältnissen beim Gesunden.
Die schwarzen Punkte entsprechen ungefärbten Zellen, also Zellen, die weder B- noch
T-Lymphozyten sind. Die Mehrzahl dieser Zellen sind die sog. Natural-Killer Zellen.
4-Farben sind Standard
Für das Beispiel wurden 2 verschiedene Fluoreszenzmarker eingesetzt. Tatsächlich gibt es
sehr viele verschiedene Fluoreszenzmarker, die in den verschiedensten Farben leuchten
können und durch verschiedene Lichtwellenlängen anregbar sind.
Moderne Durchflusszytometer für den Routineeinsatz können neben den
Streulichteigenschaften heute meist 4 verschiedene Fluoreszenzfarbstoffe unterscheiden.
Man kann also neben dem Streulicht 4 Merkmale der Zelle gleichzeitig in einem Röhrchen
färben und bestimmen. Inzwischen kommen Durchflusszytometer für den Routineeinsatz auf
den Markt, die 6 Farben gleichzeitig messen können. Dies wird die Möglichkeiten der
Analytik ganz wesentlich erweitern.
Experimentelle Geräte können schon seit einiger Zeit 10 oder mehr Farben messen,
sind aber für den Routine-Einsatz ungeeignet.
Die
Kompensation
Damit 2 oder mehrere Fluoreszenzfarben gleichzeitig verwendet werden können, muss man die
einzelnen Farben gegeneinander "kompensieren". Eine Darstellung der Kompensation
würde aber für diese einführende Betrachtung zu weit führen und ist daher auf einer eigenen Seite untergebracht. |
|
|
3.
Das Gaten ("Schleusen") Im
obigen Beispiel, bei der Darstellung der B- und T-Lymphozyten im Fluoreszenz-Dot-Plot
CD3-FITC/CD19-PE wurde etwas verschwiegen. Ohne es extra zu erwähnen, wurde eine wichtige
Auswertetechnik der Durchflusszytometrie eingesetzt: das Gaten.
Denn in diesem Dot-Plot sind nur die Lymphozyten dargestellt und Sie könnten sich fragen,
wo sind die Granulozyten und Monozyten geblieben? Die wurden durch das Gaten schon vorher
ausgeschlossen.
Ziel des Gaten ist es meist, die Zellen auszuwählen, die einen
wirklich interessieren. Bleiben wir bei dem obigen Beispiel. Wir wollten wissen, wie viele
der Lymphozyten T-Lymphozyten und wie viele B-Lymphozyten sind. Die Monozyten und
Granulozyten haben uns in diesem Fall nicht interessiert. Ja sie würden sogar die
Darstellung der Lymphozyten stören. Wir mussten sie ausgrenzen. In der Praxis
funktioniert das durch Gaten sehr einfach: man zeichnet mit der Computer-Maus eine Region
in das Streulichtdiagramm ein, die nur die Lymphozyten enthält. Man nennt diese Region
R1. Und dann "sagt man" dem Fluoreszenz-Dot-Plot: "Zeig mir nur die Zellen
aus R1". Und das geschieht dann auch. Das Computerprogramm lässt
("schleust", "gatet") nur die Zellen aus R1 in den
Fluoreszenz-Dot-Plot.
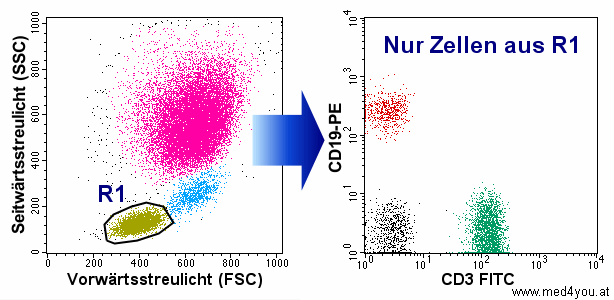
|
Region R1 im Streulicht-Dot-Plot links definiert die
Lymphozyten. Und nur diese werden in den Fluoreszenz-Dot-Plot rechts gegatet (geschleust).
Dadurch hat man im rechten Dot-Plot nur mehr die Zellen, die einen interessieren, die man
näher untersuchen möchte.
Bei einer anderen Aufgabe könnten das natürlich auch andere Zellen sein, z.B. die
Monozyten (blaue Punkte links). Dann müsste man R1 um diese Zellen zeichnen. |
Sehr komplexe Auswertungen sind möglich
Oben ist das einfachste Beispiel von Gaten dargestellt: man definiert eine Gruppe von
Zellen und gatet sie in ein anderes Diagramm. Moderne Auswerte-Programme können aber viel
mehr.
Meist lassen sich bis zu 16 verschiedenen Regionen und 16 Gates definieren, die auch noch
mit logischen Operatoren (UND, ODER, UND NICHT) untereinander verknüpft werden können. |
|
|
4.
Beispiele der Anwendung
Fall 1.
70-jähriger Patient zeigt eine erhöhte Anzahl weißer Blutkörperchen (14000/µl). Bei
der mikroskopischen Untersuchung des Blutes sieht man, dass von den verschiedenen weißen
Blutkörperchen die Lymphozyten vermehrt sind.
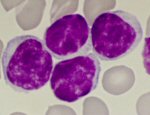 |
Bei der mikroskopischen Untersuchung zeigt sich eine
Vermehrung auffälliger Lymphozyten. |
Das kann verschiedene Ursachen haben. Man führt eine Bestimmung der T- und B-Lymphozyten
durch.
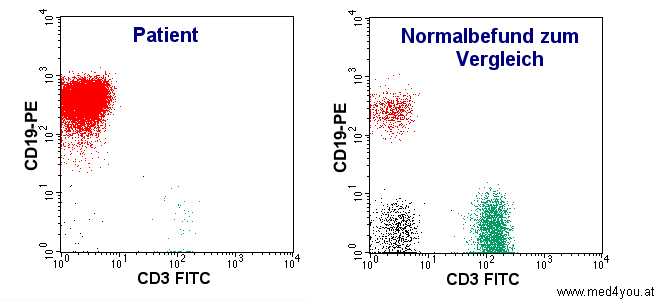
|
| Bei der durchflusszytometrischen Analyse der Lymphozyten
fällt auf, dass es sich fast ausschließlich um B-Lymphozyten (rot dargestellt) handelt.
Beim Gesunden (rechts) ist das ganz anders, da überwiegen die T-Lymphozyten (grün
dargestellt). |
Dieser Befund lässt auf einen Blutkrebs (Leukämie) der B-Lymphozyten schließen. In
einem solchen Fall werden noch zahlreiche andere Marker auf den Zellen untersucht. Unter
Berücksichtigung des Aussehens der Zellen im Mikroskop und der Beschwerden und Zeichen
des Patienten sprachen die Marker für das Vorliegen einer CLL, also einer chronisch
lymphatischen Leukämie.
Fall 2.
30-jähriger Patient mit bekannter HIV-Infektion. Um sich ein Bild von der
Leistungsfähigkeit seiner Abwehr zu machen, bestimmt man die CD4-positiven T-Lymphozyten,
die sog. Helperzellen.
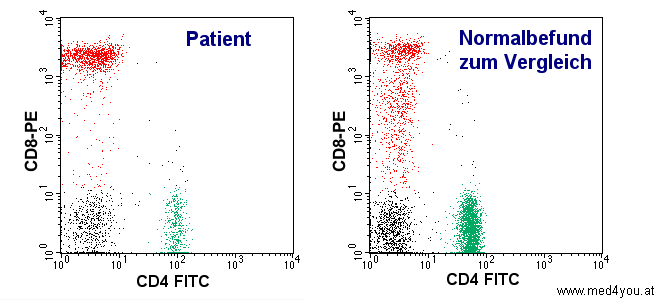
|
| Grün eingezeichnet sind die Helperzellen. Man erkennt, dass
bei dem HIV-infizierten Patienten eine deutliche Verminderung der Helperzellen vorliegt.
Unterschreitet die Anzahl der Helperzellen bestimmte Grenzen, dann wird eine vorbeugende
Behandlung mit Antibiotika empfohlen. |
|
|



