|
Einleitung
Aufgaben des Labors in der Transfusionsmedizin:
- Bestimmung von Merkmalen auf den roten Blutkörperchen
Bevor man eine Bluttransfusion durchführen kann, muss man im Labor bestimmte Merkmale
(z.B. die Blutgruppe) auf den roten Blutkörperchen des Blut-Spenders und des
Blut-Empfängers bestimmen.
- Bestimmung von Antikörpern
Außerdem muss man überprüfen, ob der Empfänger Antikörper gegen die roten
Blutkörperchen des Spenders in seiner Blutflüssigkeit (Serum) aufweist. Nur wenn keine
solchen Antikörper vorhanden sind, wird der Empfänger die Blutspende vertragen.
Für diese Aufgaben gibt es verschiedene Labormethoden, die
nachfolgend beschrieben sind.
Ergebnisse spezieller Fälle transfusionsmedizinischer Laboruntersuchungen finden Sie im
Abschnitt Fallstudien. |
|
|
|
|
|
| |
|
Agglutinationstests
|
 |
|
Einführung
- Merkmale auf den roten Blutkörperchen - sogenannte Antigene -
werden mit Hilfe ihrer "Gegenstücke" - sogenannter Antikörper - bestimmt.
Will man z.B. die Blutgruppenantigene bestimmen, gibt man zu den roten
Blutkörperchen des Patienten Antikörper gegen das Blutgruppenantigen A und B dazu. Je
nach der Blutgruppe werden sich die Antikörper gegen A oder gegen B, beide Antikörper
oder gar keine an die roten Blutkörperchen binden.
- Möchte man andererseits Antikörper gegen rote Blutkörperchen
bestimmen, verwendet man wiederum bekannte Antigene.
Beispiel: man will wissen ob ein Patient in der Blutflüssigkeit (Serum) einen
bestimmten Antikörper hat. Man nimmt rote Blutkörperchen, die das passende Antigen an
der Oberfläche aufweisen und vermischt diese mit dem Serum des Patienten. Ist der
Antikörper im Serum vorhanden wird er sich an die roten Blutkörperchen binden.
In beiden Fällen gehen Antigene und Antikörper eine Verbindung ein
= Antigen-Antikörper-Reaktion. Dabei kann man mit Hilfe des bekannten Reaktionspartners
den unbekannten Reaktionspartner identifizieren.
Voraussetzung dafür ist aber, dass die
Antigen-Antikörper-Reaktion sichtbar gemacht wird. Und am einfachsten wird die
Reaktion dann erkennbar, wenn eine Verklumpung (Agglutination) eintritt:
|
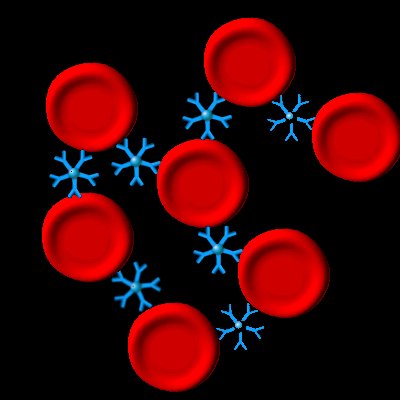
| Reagieren "große" Antikörper (sog. IgM-AK) mit roten
Blutkörperchen, bilden sich Klumpen aus roten Blutkörperchen - eine
"Agglutination" wird sichtbar. |
|
|
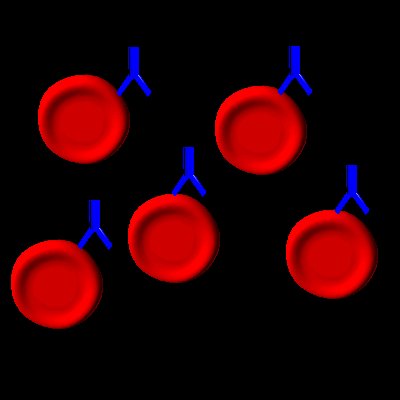
| Nicht immer ist es so einfach: Handelt es sich z.B. um
IgG-AK, ist eine Bindung an rote Blutkörperchen nicht ohne weiteres sichtbar. Es tritt
keine Verklumpung ein, da der IgG-AK zu klein ist (Rote Blutkörperchen stoßen einander
ab. Sie kommen einander normalerweise nicht so nahe, dass IgG-Antikörper sie verbinden
könnten). |
|
|
| Daher nutzt man diverse
Hilfsmittel/Zusatzstoffe, um auch in solchen Fällen eine Agglutination auszulösen (Antiglobulin-Techniken, Supplementtechnik,
Enzymtechnik). |
Prinzip:
Vermischung einer Erythrozytenaufschwemmung (in physiologischer
Kochsalzlösung) mit antikörperhältigen Seren. Es kommt zu einer
Antigen-Antikörper-Reaktion (AAR) = Spezifische Bindung von Antigen (AG) und
korrespondierendem Antikörper (AK) zu einem Antigen-Antikörper-Komplex.
Techniken:
Die Vermischung der Reaktionsteilnehmer kann im Röhrchen, auf Platte,
Objektträger, in Näpfchen oder speziellen, Gel-gefüllten Mikroröhrchen (Gelzentrifugation) erfolgen.
Während früher die Röhrchen und Plattentechniken vorherrschten, ist heute die
Gelzentrifugationstechnik am weitesten verbreitet.
| 1. |
Röhrchen Rote Blutkörperchen und Serum werden in einem Röhrchen gemischt. Danach
muss meist (je nach Anwendung) eine Inkubationsphase abgewartet werden. Dann wird das
Röhrchen zentrifugiert. Die roten Blutkörperchen bilden danach einen Knopf am Boden des
Röhrchens. Dieser Knopf wird jetzt vorsichtig aufgeschüttelt (=Resuspension):
 |
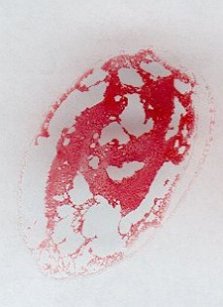
Positive Reaktion
Beim Aufschütteln sieht man Klumpenbildung. |
 |
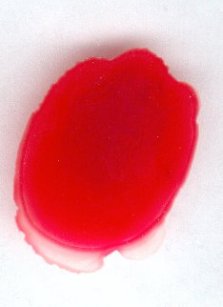
Negative Reaktion
Keine Klumpen erkennbar. |
Vorteile:
- empfindliche und sichere Methode
- keine Eintrocknungserscheinungen
Nachteile:
- Zentrifugationsschritt und evtl. Inkubationsschritt erforderlich,
daher aufwändiger als Platte bzw. Objektträger
- Falsch negative Ergebnisse durch zu kräftige Resuspension möglich
|
| 2. |
Glasplatte, Objektträger Rote Blutkörperchen und Serum werden auf einer Glasplatte vermischt (durch
Schwenken und/oder mit Hilfe von Stäbchen). Nach dem Mischen sieht man, ob die roten
Blutkörperchen verklumpen (links) oder nicht (rechts).

|

|
Positive Reaktion |
Negative Reaktion |
Vorteil:
- besonders geeignet für Eil- bzw. Notfälle.
Eine Variante der Glasplattentechnik ist die Kartentechnik. Dabei verwendet man
Karten auf denen bereits Testreagenzien (angetrocknet) vorhanden sind. Man braucht nur
mehr Blut dazuzutropfen und zu verrühren. Anwendung im sog. "Bed-Side-Test"
(letzte Blutgruppenüberprüfung vor Transfusion am Bett des Patienten).
Nachteile:
- geringere Empfindlichkeit
Eine Variante der Plattentechnik bietet eine
Steigerung der Empfindlichkeit und beträchtliche Reagenzersparnis: die sog. Bioplates.
Bioplates sind ca. Taschenbuch-große Kunststoffplatten mit über hundert durch,
kreisförmige Vertiefungen voneinander abgegrenzten Arealen, auf die man rote
Blutkörperchen und Serum aufbringen kann. Dabei wird nur sehr wenig Reagenz verbraucht. |
|

|
Positive Reaktion |
Negative Reaktion |
- Infektions- und Verletzungsgefahr durch evtl. Glasbruch
|
| 3. |
Tüpfelplatte Rote Blutkörperchen und Serum werden auf speziellen Platten mit
näpfchenartigen Vertiefungen vermischt.
Vorteil:
- Empfindlicher als Glasplatte bzw. Objektträger
Nachteil:
- Rasches Ablesen erforderlich - sonst können
Eintrocknungserscheinungen fälschlich als Agglutination beurteilt werden
|
| 4. |
Gelzentrifugation Prinzip:
Im Mittelpunkt der Geltechnik stehen kleine, mit
Dextran-Gel befüllte Röhrchen. Am oberen Ende haben sie eine trichterförmige Öffnung.
In dieser kann man rote Blutkörperchen und Serum mischen. Dann lässt man das Gemisch
eine Zeit reagieren (Inkubationszeit). Anschließend wird das Gelröhrchen zentrifugiert.
Verklumpte Blutkörperchen bleiben oben (positive Reaktion). Hat hingegen keine
Antigen-Antikörper-Reaktion stattgefunden, dann gehen die einzelnen, nicht verklumpten
Blutkörperchen durch das Gel durch und bilden unten einen Knopf (negative Reaktion).
Bei anderen Varianten der Gel-Technik sind im Gel
bestimmte Antikörper gebunden. Erythrozyten, die das passende Antigen auf der Oberfläche
tragen, bleiben bei der Zentrifugation im Gel hängen. Dies verwendet man z.B. zur
Blutgruppenbestimmung (in den Gelröhrchen ist Anti-A, Anti-B usw.) und für den sog.
Coombs-Test (bei diesem sind Antikörper gegen menschliche Antikörper im Gel. Näheres
siehe unter Antiglobulin-Techniken).
Beispiele für Gelkarten-Anwendungen
In der Blutgruppen-Antigen-Bestimmung, beim Coombs Test und der
Antikörpersuche
(dargestellt vor der Zentrifugation) |
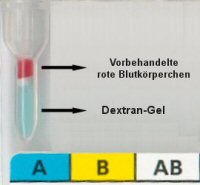 |
Für Blutgruppen- und
Rhesusfaktorbestimmung werden die roten Blutkörperchen in einer speziellen Lösung
aufgeschwemmt und in die Gel-Röhrchen pipettiert. Danach erfolgt die Zentrifugation. |
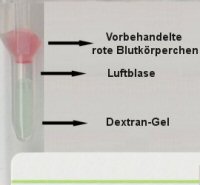 |
Für die
Bestimmung des DCT (Direkter Coombstest) werden die roten Blutkörperchen in einer
speziellen Lösung aufgeschwemmt und in die Gel-Röhrchen pipettiert. Danach erfolgt die
Zentrifugation. |
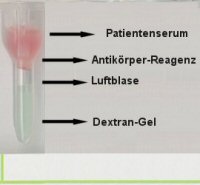 |
Für die
Antikörpersuche werden Test-Blutkörperchen und Patientenserum pipettiert und
anschließend inkubiert.
Wichtig ist das richtige Pipettieren (Luftblase
zwischen Gel und Gemisch) da es sonst zur Inaktivierung der Antikörper kommen kann. Dies
führt zu einer falsch negativen Reaktion |
Beispiel verschiedener Gel-Arten
(üblicherweise sind mehrere Gel-Röhrchen zu sog. Gel-Karten
zusammengefasst) |
Neutral-Gel
|
Aufbau: Dextrankügelchen
in Suspensionsmedium
Anwendung: Serumgegenprobe, Antikörper-Suchtest bzw. -Differenzierung |
| Spezifisches Gel AB0-Rhesus 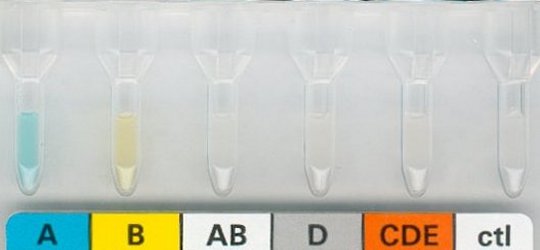
|
Aufbau: Dextrankügelchen +
Spezifische Antikörper gegen Blutgruppenfaktoren
Anwendung: Blutgruppenbestimmung |
| Spezifisches Gel Rhesusuntergruppen 
|
Aufbau: Dextrankügelchen +
spezifische Antikörper gegen Blutgruppenfaktoren
Anwendung: Rhesus- und Kellbestimmung |
| Liss/Coombs-Gel 
|
Aufbau: Dextrankügelchen +
Coombs-Serum
Anwendung: Antikörper-Suchtest bzw. -Differenzierung, ICT u. DCT |
Vorteile:
- Keine falsch negativen Ergebnisse durch z.B. zu kräftige
Resuspension
- Erfordert nur geringes Probenvolumen (Neonatologie, Pädiatrie)
- Minimaler Beschriftungsaufwand - daher rasches Arbeiten möglich
- Sauberes Arbeiten durch Einmalartikel
- Keine Waschvorgänge notwendig
- Reaktion bleibt 2 Tage lang unverändert und klar beurteilbar
- Gute Dokumentierbarkeit - durch spezielle Lesegeräte oder Fotokopie
- Klares Reaktionsbild : positive, schwach positive und negative
Reaktionen sind deutlich unterscheidbar, was eine sichere standardisierte Interpretation
der Resultate gewährleistet
Nachteile:
- Für Notfall-Blutgruppen nicht geeignet (10minütige Zentrifugation)
- Spezialzentrifuge für Gelkarten notwendig
- Hohes Müllaufkommen
|
| 5. |
Festphase (Capture, Solidscreen) Prinzip:
AG ist in einem Reaktionsgefäß (Näpfchen) an eine feste Unterlage
gebunden. Serum wird zupipettiert. Befindet sich der AK im Serum, bindet er an das AG.
Anschließend werden Antihuman-IgG beladene Indikator- Erythrozyten
zugegeben. Diese binden an den gesuchten AK. Es entsteht ein "Zellrasen" =
positive Reaktion.
Findet sich der gesuchte AK nicht im Serum, sedimentieren die
Indikatorzellen durch Zentrifugation zu Boden und bilden einen "Zellknopf" =
negative Reaktion
Spezifische Immunglobuline = Testseren sind an die Näpfchenwand
gebunden. Zu testende rote Zellen werden zupipettiert.
Befindet sich das korrespondierende AG auf den Zellen, bindet es am
Testserum. Es entsteht ein "Zellrasen" = positive Reaktion
Findet sich das gesuchte AG nicht auf den Erythrozyten,
sedimentieren diese durch Zentrifugation zu Boden und bilden einen "Zellknopf" =
negative Reaktion
 |
 |
"Zellrasen" =
Positive Reaktion |
"Zellknopf" =
Negative Reaktion |
Vorteile:
- Zur Bearbeitung von Großserien - Beschickung der Platten durch
Pipettierautomaten. Ablesen durch automatische Lesegeräte
Nachteile:
- hohe Kosten
- erfasst nur IgG-Antikörper
|
|
|
|
|
|
Quantitativer Agglutinationstest
|
 |
|
| Wie im letzten Abschnitt beschrieben, hilft
der Agglutinationstest zu erkennen, ob bestimmte
Antikörper im Serum vorhanden sind oder nicht. Meist genügt dieses Ergebnis. Manchmal
ist es jedoch notwendig, auch die Menge (= Quantität) der vorhandenen Antikörper zu
bestimmen. Dazu dient der quantitative Agglutinationstest. Man nennt ihn auch
"Titerbestimmung". |
Technik:
Ansatz von antikörperhältigem Serum in geometrischer
Verdünnungsreihe gegen Erythrozytenaufschwemmung (in physiologischer Kochsalzlösung).
Der Nachweis der letzten deutlichen Agglutination entspricht der
Titerstufe.
Anwendung:
- Abschätzung der AK-Menge (z.B. Titerkontrollen im Verlauf der
Schwangerschaft, nach Transfusionszwischenfall)
- Dosistitration - liegt ein bestimmtes Allel in doppelter oder
einfacher Dosis vor
- Erkennung reproduzierbar abgeschwächter AG z. B. A3B
- Identifizierung von z. B. Anti-I - Unterscheidung zwischen Auto- und
Allo-AK
|
|
|
|
|
Antiglobulin-Techniken
|
 |
|
Antiglobulin-Techniken werden für
verschiedene Zwecke eingesetzt. Gemeinsam ist ihnen, dass man überprüft, ob auf roten
Blutkörperchen Antikörper sitzen, also ob die roten Blutkörperchen mit Antikörpern
"beladen" sind. Das macht man, indem man Antikörper gegen diese Antikörper
zusetzt. Sind die Blutkörperchen mit Antikörpern beladen, werden sie durch Zugabe des 2.
Antikörpers verklumpt oder auf andere Weise nachweisbar.
(Da die Antikörper zu der Eiweißgruppe der Globuline
gehören nennt man diese Methoden Antiglobulin-Techniken)
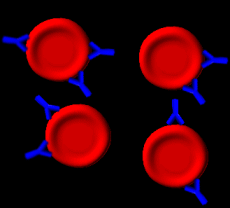
|
Die roten Blutkörperchen sind mit
Antikörpern beladen. Erkennen kann man das aber nicht, weil keine Verklumpung
(Agglutination) eintritt. |
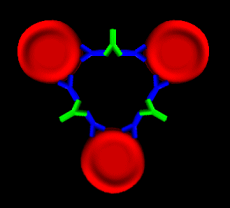 |
Gibt man Antikörper gegen die blauen
Antikörper dazu, werden die roten Blutkörperchen verbunden. Jetzt können sie
verklumpen. Diese Reaktion kann man auch mit freiem Auge in einem Glasröhrchen erkennen. |
Man wendet Antiglobulintechniken einerseits
zum Nachweis von Antikörpern im Serum oder von Antigenen auf roten Blutkörperchen (viele
sind nur mit Antiglobulin-Techniken nachweisbar). Außerdem hilft die Überprüfung einer
Antikörperbeladung der roten Blutkörperchen eines Patienten, die Ursache einer Hämolyse
(Erkrankung mit Zerstörung roter Blutkörperchen) abzuklären. |
Prinzip:
Sind menschliche Erythrozyten (in vivo oder in vitro) mit Globulin
(= Antikörper) beladen, werden sie durch AHG (= AntiHumanGlobulin)-seren
agglutiniert.
Die AHG-Seren werden durch Immunisierung von Tieren
(z.B. Kaninchen) mit menschlichen Globulinen gewonnen.
| a) |
Direkter Antiglobulintest (DCT - Direkter
Coombstest) Zum Nachweis einer in-vivo-Beladung der
Erythrozyten
Technik:
Ansatz von gewaschenen Patientenerythrozyten und AHG-Serum
Anwendung:
- Untersuchung von Transfusionsreaktionen
- Diagnose des Mhn (Morbus hämolyticus
neonatorum)
- Nachweis einer AIHA (AutoImmunHämolytischen
Anämie)
|
| b) |
Indirekter Antiglobulintest (ICT - Indirekter
Coombstest) Technik:
Zuerst wird antikörperhältiges Serum mit entsprechenden
Testerythrozyten inkubiert und anschließend werden die Erythrozyten gewaschen.
Danach wird AHG-Serum zugegeben. Es erfolgt die Zentrifugation und
das Ablesen der Reaktion.
Anwendung:
- Nachweis und Identifizierung von Antikörpern
- Kreuzprobe
- Bestimmung von Erythrozytenantigenen, die mit anderen Methoden nicht
nachweisbar sind
|
|
|
|
|
|
|
|
|
Supplementtechnik (früher
Konglutinationstest)
|
 |
|
Wie im Abschnitt Agglutinationstest beschrieben, kann man mit bekannten
Antikörpern gewisse Merkmale (Antigene) auf den roten Blutkörperchen nachweisen.
Umgekehrt kann man mit roten Blutkörperchen, deren Merkmale man kennt, überprüfen, ob
bestimmte Antikörper im Serum vorhanden sind oder nicht.
Im einfachsten Fall gibt man Serum und rote Blutkörperchen zusammen. Finden die
Antikörper passende Antigene auf den roten Blutkörperchen, werden sie sich an diese
binden und zur Verklumpung (Agglutination) bringen, was man leicht erkennen kann.
In vielen Fällen genügt es jedoch nicht, nur ein Gemisch aus "Antikörpern"
und "Antigenen" herzustellen. Der Antikörper verbindet sich zwar mit dem roten
Blutkörperchen, er ist aber zu klein, um eine zweite Zelle zu erreichen. Es kommt zu
keiner Verklumpung.
Daher nutzt man verschiedenen Hilfsstoffe, wie z.B. Albumin, um dennoch eine Verklumpung
zu erreichen. Dies nennt man Supplement-Technik. |

|

|
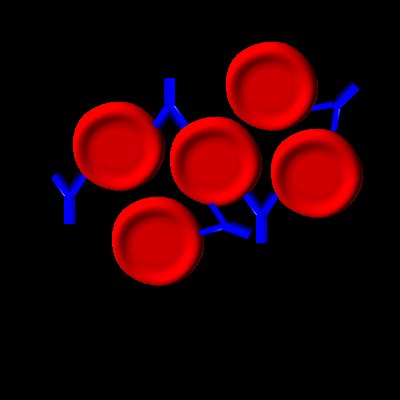
|
Die blauen Antikörper sind zu
klein, sie können keine Verklumpung auslösen.
(Rote Blutkörperchen stoßen einander ab. Sie kommen einander
normalerweise nicht so nahe, dass IgG-Antikörper sie verbinden könnten) |
|
Zugabe des Supplements Albumin
verringert die Abstoßung der roten Blutkörperchen. Jetzt können sie durch den
Antikörper verklumpt werden. |
Prinzip:
Entspricht dem des qualitativen
Agglutinationstests.
Technik:
Durch Zugabe von Supplement (meist Albumin) wird das
Zetapotential der Erythrozyten verringert. Dadurch wird die Abstoßung der Erythrozyten
voneinander verringert und auch IgG-Antikörper können eine Agglutination auslösen.
Dadurch können IgG-AK leichter identifiziert werden.
Wird heute selten angewendet, da weniger
empfindlich als Antiglobulintest oder Enzymtechniken.
|
|
|
|
|
Enzymtechniken
|
 |
|
Wie im Abschnitt Agglutinationstest beschrieben, kann man mit bekannten
Antikörpern gewisse Merkmale (Antigene) auf den roten Blutkörperchen nachweisen.
Andererseits kann man mit roten Blutkörperchen, deren Merkmale man kennt, überprüfen ob
bestimmte Antikörper im Serum vorhanden sind oder nicht.
Im einfachsten Fall gibt man Serum und rote Blutkörperchen zusammen. Finden die
Antikörper passende Antigene auf den roten Blutkörperchen, werden sie sich an diese
binden und zur Verklumpung (Agglutination) bringen, was man leicht erkennen kann.
In vielen Fällen genügt es jedoch nicht, nur ein Gemisch aus "Antikörpern"
und "Antigenen" herzustellen. Der Antikörper verbindet sich zwar mit dem roten
Blutkörperchen, er ist aber zu klein, um eine zweite Zelle zu erreichen. Es kommt zu
keiner Verklumpung.
In diesen Fällen kann verschiedene Hilfsstoffe einsetzen, um eine sichtbare Reaktion zu
bekommen. Bei der Enzymtechnik werden bestimmte Enzyme (Biokatalysatoren) eingesetzt, die
die Oberfläche der roten Blutkörperchen verändern und eine Verklumpung erleichtern. |

|

|

|
Die blauen Antikörper sind zu
klein, sie können keine Verklumpung auslösen.
(Rote Blutkörperchen stoßen einander ab. Sie kommen einander
normalerweise nicht so nahe, dass IgG-Antikörper sie verbinden könnten) |
|
Zugabe von Enzym
(oder Vorbehandlung der roten Blutkörperchen) mit Enzym verringert die Abstoßung der
roten Blutkörperchen. Jetzt können sie durch den Antikörper verklumpt werden. |
Prinzip wie
Supplementtechnik.
Statt Albumin werden aber Enzyme verwendet. Diese proteolytischen
Enzyme wie Bromelin (aus Ananas), Papain (aus Carica papaya) oder Ficin (aus der Feige)
reduzieren das Zetapotential der Erythrozyten durch Ladungsveränderung an der
Zelloberfläche. Dadurch wird die Abstoßung der
Erythrozyten voneinander verringert und auch IgG-Antikörper können eine Agglutination
auslösen. Dadurch können IgG-AK leichter identifiziert werden.
Technik:
Probandenserum, Testerythrozyten und Enzym werden gleichzeitig
angesetzt, anschließend inkubiert und zentrifugiert
In einem ersten Schritt werden Testerythrozyten und Enzym inkubiert
und erst anschließend wird Probandenserum zugesetzt
Vorteile:
- Nachweis von inkompletten IgG-AK - diese können sich zwar an
Erythrozyten anlagern, es kommt jedoch ohne Hilfsmittel zu keiner Agglutination
- Empfindlicher als Supplementtechnik
Nachteile:
Durch Proteasewirkung kommt es zur Zerstörung bestimmter AK bzw. AG
wie z. B. M, N, Fya+b,...
- Mehr Unspezifitäten durch erhöhte Empfindlichkeit
Anwendung:
Besonders gut geeignet zum Nachweis von Rhesus- und Kälte-Antikörpern
|
|
|
|
|
Absorptionstechniken
|
 |
|
| In der menschlichen Blutflüssigkeit befinden
sich spezielle Eiweißstoffe (= Antikörper), von denen sich manche an rote
Blutkörperchen binden können. Diese Tatsache macht man sich
bei der sog. "Absorptionstechnik" zu Nutze: Man fügt der menschlichen
Blutflüssigkeit im Laborversuch bestimmte rote Blutkörperchen zu. Die zu den
Blutkörperchen passenden Antikörper verbinden sich mit diesen zu Komplexen.
Beim Zentrifugieren sinken diese Komplexe zu Boden und man erhält
eine Flüssigkeit, die frei von den gebundenden Antikörpern ist. |
Absorption = Entfernung eines AK aus
dem Serum
Technik:
Ansatz von antikörperhältigem Serum mit
Erythrozyten, die das AG tragen, gegen das der AK gerichtet ist.
Es bildet sich ein AG-AK-Komplex. Durch
Abzentrifugieren der Erythrozyten erhält man ein Serum, aus dem der AK, der gegen die
Erythrozyten gerichtet war, entfernt ist (oder zumindest stark vermindert ist).
Anwendung:
Trennung von AK
verschiedener Spezifität
Entfernung von Auto-AK um
eventuell vorhandene Allo-AK nachzuweisen
Bestätigung einer
AK-Spezifität
|
|
|
|
|
Elutionstechniken (Antikörper-Absprengung)
|
 |
|
| In der menschlichen Blutflüssigkeit befinden
sich spezielle Eiweißstoffe (= Antikörper), die sich an bestimmte Merkmale der
roten Blutkörperchen (Antigene) binden können. Diese Verbindung von Antikörper und Antigen nennt man auch
Antigen-Antikörper-Komplex.
Liegen solche Komplexe vor, kann es notwendig sein, die
Antikörper von den Antigenen zu trennen. Meist tut man dies, um zu erkennen, um welche
Antikörper es sich handelt.
Dies geschieht unter Zuhilfenahme diverser Chemikalien oder
einfach durch Temperaturveränderung.
Nach der Absprengung (= Elution) können die Antikörper
mit diversen Methoden weiter untersucht werden (Agglutinationstest,
Quantitativer Agglutinationstest, Supplementtechnik, Enzymtechnik,
Antiglobulin-Technik,..) |
Elution = Entfernung eines auf der
Oberfläche von Erythrozyten adsorbierten AK. Die Adsorption des AK kann in vivo (z. B.
bei Autoimmunreaktion) oder in vitro erfolgt sein.
Technik:
Die Absprengung des AK kann durch verschiedene
Methoden erfolgen:
Hitze, Kälte, Säure, Ultraschall, Wärme, Aether,
Chloroform,...
Das AK-Molekül darf bei der Elution nicht zerstört
werden, seine AG-bindende Funktion muß erhalten bleiben! Man will es ja nachher noch
identifzieren.
Anwendung:
Nachweis und Identifizierung von AK auf kindlichen
Zellen bei Mhn
Nachweis und Identifizierung von AK bei
hämolytischen Anämien oder Transfusionsreaktionen (positiver DCT !)
Entfernung von AK nach Absorption zur weiteren
Identifizierung
Nachweis von schwachen AG an Erythrozyten
|
|
|
|
|
Lysintest
|
 |
|
In der menschlichen Blutflüssigkeit befinden
sich spezielle Eiweißstoffe - sogenannte Antikörper. Fallweise treten Antikörper auf,
die gegen rote Blutkörperchen gerichtet sind.
Bei einer Bluttransfusion kann es dann zu einer Reaktion zwischen diesen Antikörpern und
den transfundierten roten Blutkörperchen kommen, das heißt, die Antikörper binden an
die roten Blutkörperchen.
In vielen Fällen werden solche Antikörper-beladenen roten Blutkörperchen vor allem in
der Milz langsam abgebaut.
In manchen Fällen kann es aber auch eine raschere Zerstörung der roten Blutkörperchen
noch in den Blutgefäßen kommen. Man spricht dann von "intravaskulärer
Hämolyse".
Diesem Prinzip folgend, kann man im Laborversuch die "Gefährlichkeit" von
Antikörpern testen: Man gibt das antikörperhältige Serum und die roten Blutkörperchen
zusammen und überprüft, ob eine Hämolyse eintritt. |
Prinzip:
In Gegenwart von Komplement (in jedem frischen
menschlichen Serum enthalten) kann anstelle der Agglutination eine Hämolyse auftreten.
Technik:
Der Ansatz von Erythrozytenaufschwemmung mit
antikörperhältigem Serum erfolgt im Röhrchen. Die Hämolyse ist im Röhrchen gut
erkennbar:
Achtung:
Hämolyse nicht fälschlicherweise als negative Reaktion bewerten.
Im Vergleich zur Hämolyse imponiert eine
negative Reaktion trüb:
Anwendung:
- Zur Erkennung von Hämolysinen (= AK, die
die Komplementkaskade aktivieren und zur Lyse von Erythrozyten führen können) wie z. B.
Anti A, Anti B, Anti AB, Anti I, Anti i, Anti Lea+b, Anti Jka+b, Anti Tja, Anti Vel,...
|
|
|
|
|
Inhibitionstechnik
|
 |
|
Nicht nur auf den roten Blutkörperchen, auch
in anderen Flüssigkeiten wie z.B. im Speichel findet man Blutgruppeneigenschaften. Will
man diese erkennen, kann man sich der sogenannten "Inhibitionstechnik"
bedienen.
Dabei gibt man Antikörper gegen ein Blutgruppenmerkmal (z.B. Anti-A) zu der
Speichelprobe. Sind im Speichel Blutgruppenmerkmale der Gruppe A, wird sich der
Anti-A Antikörper an diese binden. Ist er gebunden, ist er aber nicht mehr wirksam, er
ist "inhibiert".
Setzt man jetzt in einem 2 Schritt Blutkörperchen der Gruppe A zu, wird keine
Reaktion mehr eintreten. Führt man dies mit verschiedenen Antikörpern und
Blutkörperchen durch, lässt sich die Blutgruppe im Speichel ermitteln. |
Inhibitionstechnik ist eine spezielle
Form der Absorptionstechnik.
Von Absorption spricht man, wenn die AG, die den AK
absorbieren an Zellen gebunden sind, von Inhibition, wenn diese AG in einer Flüssigkeit
(z. B. Speichel, Serum) gelöst vorliegen.
Technik:
Ansatz von z.B. Speichel mit antikörperhältigem Serum. Anschließend
Zugabe von geeigneten Erythrozyten.
Ist das gesuchte AG im Speichel enthalten, wird der zugesetzte AK inhibiert und kann nicht
mit den nachfolgend beigefügten Zellen agglutinieren
Ist das gesuchte AG nicht enthalten, kommt es zur Agglutination von AK und beigefügten
Zellen.
Anwendung:
|
|
|
|
|
Molekularbiologische Methoden
|
 |
|
Molekularbiologische Methoden in der
Transfusionsmedizin untersuchen vor allem die menschliche DNA
(= Desoxyribonukleinsäure).
Als DNA bezeichnet man die Erbinformation-tragenden
Ketten in den Chromosomen. Die Gesamtheit der Erbinformation nennt man Genom. Chromosomen
sind fadenförmige Strukturen, die im Zellkern von bestimmten Zellen vorliegen.
Anwendungen: HLA-Typisierung (vor Transplantationen oder zur Abschätzung von
Krankheits-Risiken), Vaterschaftstest, Täterermittlung in der Kriminalistik. |
| 1. |
RFLP (Restrictions Fragment Length
Polymorphismus) Prinzip:
Restriktionsendonukleasen können doppelsträngige DNA bei bestimmten
Nukleotidsequenzen (= Restriktionsstelle) "schneiden".
Diese Schnittstellen sind über die gesamte DNA eines Individuums
zufällig verteilt. Durch mutationsbedingten Basenaustausch werden solche Schnittstellen
zerstört, wodurch die Längenvariabilität der DNA-Fragmente verschiedener Menschen
entsteht.
Technik:
Nach Behandlung der DNA mit Restriktionsendonukleasen können die
DNA-Fragmente nach Größe getrennt werden. Anschließend werden diese auf Nitrozellulose
geblottet und mit einer speziell markierten Gensonde inkubiert. Der Nachweis erfolgt durch
Autoradiographie, Fluoreszenz, Histochemie oder andere Methoden.
Anwendung:
- HLA-Typisierung
- Paternität (Vaterschaftstest)
- Forensische Medizin (Gerichtsmedizin)
|
| 2. |
PCR (Polymerase-Chain-Reaction) = Primer mediierte spezifische Amplifikation (Vermehrung) kurzer
DNA-Segmente (100 - 3000 Basen) mittels einer DNA-Polymerase
Prinzip:
siehe PCR-Technik
Anwendung:
- HLA-Typisierung (vorwiegend Klasse II)
- Identifizierung seltener Blutgruppen
- Paternität
- Forensische Medizin
|
|
|
|
|
|



